 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
2036
F: Ich habe zusammen mit Schülern Ihren Versuch mit dem Zink-Iod-Akku
durchgeführt. Ich bin zunächst von einer Zink-iodid-Lösung ausgegangen. Zur Elektrolyse zum Laden des Akkus haben wir einen niederohmigen
Propeller-Elektromotor als Dynamo benutzt, indem wir ihn kurze Zeit mit einem Fön® angetrieben haben. Dann haben wir den Fön ausgestellt.
Wie zu erwarten, lief der Motor weiter - aber viel, viel länger als die Elektrolyse gedauert hat - sogar mehrere Stunden! Wie kann das
kommen? Wir haben gedacht, dass die Zeiten von Laden und Entladen gleich sein müssten. Also: Die elektrische Arbeit sollte in beiden
Fällen gleich sein. Können Sie uns helfen?
A: Zunächst einmal haben Sie kein Perpetuum mobile erfunden, also einen Apparat, der ohne
Energiezufuhr Arbeit leistet. Um die Ladung mit der Entladung zu vergleichen, müssen Sie die elektrischen Ladungen kennen. Dazu messen Sie
die jeweilige Stärke des Stroms, der beim Laden und beim Entladen fließt, und halten dazu auch die Zeit des Stromflusses fest.
Zum Laden haben Sie den Motor sehr stark angeblasen, so dass kurzzeitig viel Strom geflossen ist. Beim Entladen läuft der Motor offensichtlich viel langsamer. Es fließt weniger Strom, das aber für längere Zeit. Ursache für die Langsamkeit sind gehemmte chemische Prozesse an den Elektrodenoberflächen, bremsende Ionenwanderungen in der Lösung (usw.). Das erkennen Sie auch, wenn Sie die Versuchsanordnung aufmerksam betrachten: So diffundiert zum Beispiel sehr viel Iod von der Anode in die Lösung und steht somit der Entladungsreaktion nicht mehr ausreichend rasch zur Verfügung.
Sie können deshalb nicht erwarten, dass die hineingesteckte Arbeit quantitativ zurückgewonnen werden kann. Das verstößt bekanntlich auch gegen den II. Hauptsatz der Thermodynamik (Entropie-Satz). Anders gesagt: Der Wirkungsgrad von Akkumulatoren kann nicht gleich 1 werden.
2037
F: Jetzt beginnt wieder das Kröten-Einsammeln. Bei den Vorbereitungen müssen wir den Helfern
immer sagen, dass sie beim Berühren von Kröten und Salamandern vorsichtig sein sollen. Vor allem letztere sollen sehr giftig sein.
A: Das stimmt. Salamander scheiden über Hautdrüsen Alkaloide aus. Das wichtigste heißt
Samandarin.
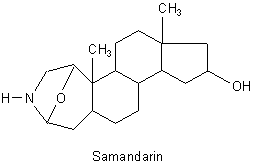
Es handelt sich um ein Steroid-Alkaloid aus der Gruppe der 3-aza-A-homo-Sterane. Bei denen ist der linke normalerweise 6er-Ring A durch ein eingebautes Stickstoffatom zu einem 7er-Ring aufgeweitet.
Physiologisch wirksam ist das Toxin nur, wenn es oral aufgenommen wird. Dann kommt es zu Erbrechen, Lähmungen sowie Herz-Kreislauf-Problemen bis zum Tod.
Das Gift soll übrigens nach Vanille duften. Ich gebe zu, dass ich noch nie an einem Salamander geschnuppert habe, werde es aber beim nächsten Treffen mit ihm nachholen. Vor den Tieren sollte man sich nicht ekeln, denn sie fühlen sich erstaunlich trocken an. Danach aber gut die Hände waschen!
Literatur
E. Teuscher, U. Lindequist: Biogene Gifte; Wissenschaftliche Verlagsgesellschaft, 3. Auflage, Stuttgart 2010.
2038
F1: Gegen Hyperhidrose nimmt man Aluminiumchlorid. Dasa möchte ich mir beschaffen und stehe
nun vor folgendem Problem: Können Sie mir sagen, ob Aluminium-Chlorat dasselbe ist, wie Aluminiumchlorid-Hexahydrat?
A1: Hyperhidrose ist überschießende Schweißbildung. Dagegen kann man Aluminiumsalze
einsetzen. Die wirken auf Eiweiß fällend, also wie ein Gerbstoff und schädigen deshalb die Schweißdrüsen. Außerdem sind sie antibakteriell.
Man kann Alaun (KAl(SO4)2 • 12 H2O) oder auch Aluminiumchlorid einsetzen.
Wichtig: Aluminiumchlorid kommt in zwei Formen vor: Einmal als wasserfreies, in der Chemietechnik gebräuchliches Aluminiumchlorid (Formel: AlCl3) sowie als wasserhaltiges Aluminiumchlorid-Hexahydrat (AlCl3 • 6 H2O). Letzteres wird normalerweise im Haushalt genutzt - z. B. in Deodorantien oder in der Färbetechnik.
Aluminiumchlorat dagegen ist ein ganz anderes Salz (Formel: Al(ClO3)3). Es ist schon eine etwas ungewöhnliche Substanz. Ich vermute deshalb, dass Sie auf die altertümliche Bezeichnung Aluminium chloratum gestoßen sind. Darunter verstehen Apotheker und solche Leute, die der Homöopathie nahe stehen, Aluminiumchlorid-Hexahydrat. Bekanntlich heißt bei denen Kochsalz nicht Natriumchlorid, sondern Natrium chloratum - was zu schlimmen Verwechselungen führen kann. Denn Natriumchlorat ist ätzend, Bestandteil von Sprengstoffen und dazu noch als Unkrautgift wirksam („Unkraut-Ex“).
Wegen dieser Namensverwirrung sollten Sie vor der Beschaffung der Substanz den Lieferanten genau befragen, denn wasserfreies Aluminiumchlorid ist stark ätzend, weil es in Kontakt mit Wasser Salzsäure freisetzt. Man erkennt es daran, dass es - anders als das farblose Hydrat - gelb ist.
F2: VIELEN DANK!
2039
F: In einer Millionärs-Sendung mit Günther Jauch behauptete eine Bierfachfrau, dass sie schon
einmal 57%iges Bier getrunken habe. Das geht doch gar nicht, weil die Hefen ihre Gärung bei ca. 16 % Alkoholgehalt einstellen.
A: Sie haben Recht, wenn Sie annehmen, dass es sich nicht um normales Bier handeln kann. Ich
habe ein derartig hochprozentiges Bier um die 1960er Jahre schon einige Male in Regensburg getrunken. Es war dunkel und hatte eine
etwas ölige Konsistenz. Man hat das Bier wie folgt hergestellt: Normales Bockbier wurde in ein Fass mit Holzdauben gefüllt. Das Fass
wurde anschließend eingefroren. Dann hat man die Fassdauben entfernt und den resultierenden Eisblock angestochen. Heraus kam das
Superstarkbier. Es schmeckt wie Bier, aber hat eine ziemlich durchschlagende Wirkung. Deshalb (und weil es so kostbar ist) servierte
man es nur in kleinen Schnapsgläsern.
Dahinter steckt, dass Wassereis kaum Fremdsubstanzen einschließt und beim Ausfrieren die Bierinhaltsstoffe (wozu auch der Alkohol gehört) in der flüssigen Gleichgewichtsphase zurückbleiben, sich also anreichern. Damit wird das Bier aufkonzentriert.
2040
F1: Ich würde gerne wissen, warum eine Eiklar- "Lösung" aufklart, wenn man Natriumchlorid hinzugibt.
Herzlichen Dank für Ihre Antwort!
PS: Ihre Webseite ist großartig! Vielen Dank auch hierfür!
A1: Was meinen Sie mit "Klären" einer Lösung? Ich meine, dass Eiklar mit destilliertem
Wasser klare Lösungen bildet. Beschreiben Sie deshalb etwas genauer, was Sie beobachten, wenn Sie NaCl zugeben.
F2: Wenn man Eiklar in Wasser gibt, ich hatte Leitungswasser verwendet, dann bildet sich
eine getrübte Lösung und Schlieren sind zu erkennen. Nach der Zugabe von einem Spatel NaCl verschwinden die Schlieren und die Lösung
sieht ganz klar aus.
A2: Im Leitungswasser sind bekanntlich reichlich Härte-bildende
Ionen vorhanden, vor allem zweiwertige Kationen wie Ca2+ und Mg2+. Diese binden an die Proteine, die ja
bekanntlich viele anionische Gruppen wie COO- aufweisen. Dabei verknüpfen sie auch Eiweißmoleküle untereinander zu großen
Aggregaten, was zu deren Ausflocken führt. Durch Zugabe von Na+-Ionen im Überschuss werden die zweifach geladenen Kationen
wieder verdrängt, denn es kommt zur Bindung von Na+ an die anionischen Gruppen der Proteine. Letztlich kennen wir ein solches
Verhalten von Ionenaustauschern. Damit entfällt aber auch der Zusammenhalt zwischen den Proteinmolekülen;
es kommt zur Wiederauflösung der Eiweißflocken.
Deshalb: Eiklar muss man mit destilliertem (demineralisiertem) Wasser verdünnen. Beim Salzeinsatz sollte man darauf achten, dass es sich um reines Kochsalz handelt. Das übliche Küchenkochsalz dagegen enthält Calciumcarbonat und bildet deshalb von vornherein trübe Lösungen.