 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
561
F: Suche dringend den Nachweis des Silberions
A: Gib zu der Lösung, die du zuvor mit Salpetersäure ansäuerst,
eine Lösung von Natriumchlorid. Es bildet sich ein weißer Niederschlag von Silberchlorid, der sich nach
kurzer Zeit im Licht dunkel färbt.
AgNO3 (löslich) + NaCl (löslich) ———> AgCl (schwer löslich) + NaNO3 (löslich)
562
F: In meiner Facharbeit beschäftige ich mich mit Konservierungsstoffen.
Nun wollte ich Sorbinsäure in Mayonaise qualitativ und evtl. quantitativ nachweisen. Die Nachweismethoden,
die ich bis dato gefunden habe, sind jedoch entweder an der Schule nicht durchführbar bzw. sehr kompliziert.
Kennen Sie evtl. etwas leichtere, jedoch für eine Facharbeit verwertbare Versuche?
A: Es gibt meines Erachtens hierzu keinen für die Schule geeigneten
Versuch. In der wissenschaftlichen Analytik bedient man sich - nach entsprechender aufwendiger Probenvorbereitung
- der HPLC. (Siehe dazu unsere Webseite.)
Wer denkt sich bloß diese Facharbeitsthemen aus? Es wäre besser, wenn Sie stattdessen mit den fundamentalen
Chemie-Inhalten bekannt gemacht würden.
563
F: Die Spannungsreihe gibt ja gewissermassen an, wie stark ein Metall
in Form von Ionen in Lösung geht. Fragen: Gehen Metalle, Halbmetalle und Nichtmetalle in einem Elektrolyten
in Lösung, oder nur Metalle? Gehen die Stoffe immer in Form von positiven Ionen in Lösung?
A: Wenn Sie die Spannungsreihen-Tabellen ansehen, werden Sie feststellen,
dass es die nicht nur für Metalle, sondern auch für Nichtmetalle gibt.
Bei der Angabe der Werte ist immer das Redox-Gleichgewicht vermerkt, auf das sich der Wert bezieht. Links
steht immer die reduzierte Form, rechts die oxidierte. Beispiel:
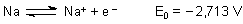
Natürlich entstehen auch negative Ionen - wie zum Beispiel bei den Halogenen.
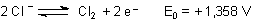
Beim Sauerstoff entstehen OH--Ionen.
564
F: Im Rahmen einer Klausur zum Praktikum der Anorganischen Chemie wurde
gefragt, mit welchen Hilfsmittel es möglich ist anhand der Flammenfärbung der (Erd-) Alkalisalze das jeweilige
Metall nachzuweisen. Als Antwort wählte ich das Spektrometer, jedoch wollte der Korrektor nur das Spektroskop
akzeptieren und beantwortete auch nicht die Frage ob mit dem Spektrometer nicht prinzipiell dasselbe möglich
ist (als Grund wurde angegeben dass wir im Praktikum nur die alten Spektroskope hatten auch wenn in Fachbüchern
heute angeblich nur noch Spektrometer genannt werden). Da in meinem Fall speziell diese Frage über
Nichtbestehen oder Bestehen der Klausur entscheidet interessiert mich dies sehr. Ich bedanke mich
schon einmal im Vorraus.
A: Ihr Korrektor hat Recht. Ein Spektroskop zerlegt das Licht
einer Strahlungsquelle (Sonne, Flamme des Bunsenbrenners...) spektral mit dem Ziel, die Verteilung der
Intensität auf bestimmte Wellenlängenbereiche aufzuspüren. So findet man zum Beispiel die Linien der
Alkali- und Erdalkalimetalle.
Ein Spektrometer/Spektralfotometer hat eine möglichst kontinuierliche Strahlungsquelle mit einem weiten
Spektralbereich, dispergiert die Strahlung/das Licht und misst für einzelne Wellenlängenbereiche die
Intensitätsminderung/Absorption durch in den Strahlengang eingebrachte Substanzen (bzw. bei
Fluoreszenzmessungen auch Intensitäten).
565
F: Bei der Fällung von Ni, Co, Mn, Zn, Fe, Al und Cr mit
Ammoniumsulfid, muss vorher mit Ammoniak alkalisch gemacht werden. Jetzt meine Frage: Warum ist das so.
Müssen beim Beispiel für die Reaktion irgendwie OH-Ionen anwesend sein, aber diese haben doch eigentlich
nichts mit der Reaktion an sich zu tun. Oder dienen die OH- bzw. H-Ionen mehr als Katalysator oder ähnliches.
A: Das hängt mit dem kleinen Löslichkeitsprodukt der Sulfide der
genannten Elemente zusammen. H2S ist eine sehr schwache Säure. Nur in alkalischem Milieu sind
genügend S2--Ionen (anstelle von gelöstem H2S und daraus gebildeten HS--Ionen)
zur Ausfällung vorhanden. Dabei bilden sich auch gemischte Sulfide und Hydroxide.
Außerdem fallen dann auch die Hydroxide von Cr und Al aus.
Ammoniumsulfid nimmt man anstelle von Natriumsulfid, weil man das Ammonium später durch Abrauchen leicht
entfernen kann.