Die Chemie der Fullerene
|
Die Chemie der Fullerene |
|
Experimente:
Versuch: Aromatenprobe mit Fullerenen
Aus der Molekülstruktur des C60 können
bereits wichtige Eigenschaften abgeleitet werden, die das chemische Verhalten
wesentlich bestimmen. Alle Kohlenstoffatome im C60 sind sp2-
hybridisiert und in ihren Eigenschaften identisch. Jedes Atom ist mit drei
weiteren über eine Doppel- und zwei Einfachbindungen verknüpft, wobei
Doppel- und Einfachbindungen alternierend auftreten.
a) Grundlagen
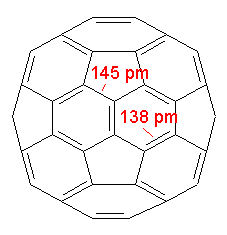
Struktur des C60-Buckminsterfullerens |

Kristalle von C60 [Foto: Blume] |
Für ein derartiges Molekül würde man annehmen, dass es aromatischen Charakter besitzt, d.h. die pi-Elektronen sind delokalisiert, und alle Bindungen sind gleichlang. Dies ist im C60 jedoch nicht der Fall; die Bindungen zwischen zwei Kohlenstoff-Sechsringen sind mit 138 pm deutlich kürzer als die Bindungen zwischen einem Fünf- und einem Sechsring (145 pm). Sie besitzen Doppelbindungscharakter, während die letzteren Einfachbindungscharakter haben. Dies schließt eine vollständige Delokalisierung der pi-Elektronen aus. Tatsächlich zeigt C60 Reaktionen, die denen konjugierter, elektronenarmer Polyalkene gleichen.
Eine bevorzugte Reaktion von C60 ist die Addition. Das normalerweise planare sp2-System ist auf der gewölbten Oberfläche des C60- Moleküls stark gespannt. Die Spannungsenergie beträgt ca. 80 % der Bildungswärme des Moleküls und schafft damit eine energetisch ungünstige Situation. Bei der Addition an ein C60-Kohlenstoffatom geht dieses vom sp2- in den sp3-Zustand über.
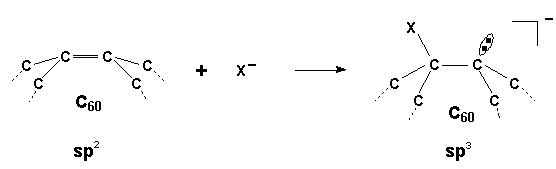
Übergang vom sp2- in den sp3-Zustand bei Addition eines Nucleophils
Bei nunmehr vier Bindungspartnern bevorzugt Kohlenstoff eine tetraedrische Geometrie. Dies führt im C60 unter Ausbeulung der kugeligen Struktur zunächst zu einem Abbau von Spannungsenergie. Dabei wird aber nicht die Anlagerung an alle 30 Doppelbindungen des C60 beobachtet, da die Ausbeulung der kugeligen Struktur nur bis zu einem gewissen Grad erfolgen kann. Man hat z. B. die Anlagerung von maximal 24 Bromatomen oder 26 Hydroxylgruppen beobachtet. Darüber hinaus würde das Molekül aufgrund der erneut auftretenden starken Spannungen instabil.
Aus den gleichen Gründen besitzt C60 Elektronenakzeptor-Eigenschaften. Bei der Aufnahme
von Elektronen bilden sich negativ geladene Kohlenstoffatome (Carbanionen), die eine
tetraedrische Geometrie ausbilden und somit die Spannung im Molekül erniedrigen. Bei der
Abgabe von Elektronen würden sich hingegen positiv geladene Carbenium-Ionen bilden, die
eine planare Struktur anstreben und somit die Spannung erhöhen. Aufgrund der
Elektronenakzeptor-Eigenschaften lassen sich vor allem Nucleophile leicht an das C60-Molekül
addieren.
Schüler kommen beim Betrachten der "Molekül"-Struktur der Fullerene auf die Idee, dass es sich
bei den Fullerenen um Aromaten handeln könnte. Tatsächlich gibt es auch eine
polykondensierte Verbindung, die zumindest einen Ausschnitt eines Fullerens darstellt: das
Corannulen.
Corannulen Um zu untersuchen, ob es sich bei einer Substanz um eine aromatische Verbindung handelt,
greift man in der Schule gern auf die Aromatenprobe zurück (Experimente,
V 19). Diese muss
bei Fullerenen natürlich negativ ausfallen, da es sich bei dieser Probe um eine
Friedel-Crafts-analoge Substitutionsreaktion handelt, bei der der Wasserstoff durch einen
Alkylrest ersetzt wird. Entsprechend reagiert auch Hexamethylbenzol nicht (siehe Experimente,
V 19).
Somit ist nicht das Ausbleiben der Aromatenprobe ein Hinweis auf fehlende Aromatizität,
sondern die Bereitschaft der Fullerene, trotz Elektronenanhäufung extrem leicht zu nukleophilen
Substitutionsreaktionen zu neigen.
Fullerene sind also mehr als nur eine neue Kohlenstoffmodifikation. Sie sind auch nicht
wasserstofffreie, polykondensierte, aromatische Kohlenwasserstoffe (PAK), sondern Riesenalkene.
Dies zu zeigen ist mit Hilfe der folgenden "class room experiments" leicht möglich.
b) Schulexperimente mit C60
Die folgende Abbildung zeigt eine Übersicht über einige mögliche Reaktionen mit C60,
die in der Schule durchgeführt werden können. (Der Übersichtlichkeit wegen
ist nur die Addition an eine Doppelbindung dargestellt.)
Vorteilhaft ist, dass mit C60
auch ungewöhnliche Alken-Reaktionen wie Hydrierung, Cycloaddition oder Carbanionen-Bildung im
Schulunterricht möglich sind. Die meisten dieser Versuche eignen
sich unter Berücksichtigung der Sicherheitsaspekte auch als Schülerversuche.
Chemische Reaktionen mit Fullerenen laufen in der Regel unter deutlich sichtbaren
Farbveränderungen ab und sind deshalb visuell verfolgbar. Bei den Reaktionen
ergibt sich ein Produktgemisch aus unterschiedlich gebauten Fullerenaddukten.
Das führt häufig zu unspezifischem spektroskopischen Verhalten (Absorption über
einen breiten Wellenlängenbereich hinweg). Das ist auch der Grund für das häufige
Auftreten von orangeroten bis braunen Farbtönen.
Werden mehrere verschiedene Versuche durchgeführt, so bewahrt man die
Lösungen der Endprodukte auf und stellt sie nebeneinander. Auf diese Weise
lässt sich sehr schön die Farbenvielfalt der unterschiedlichen
Fullerenderivate zeigen.
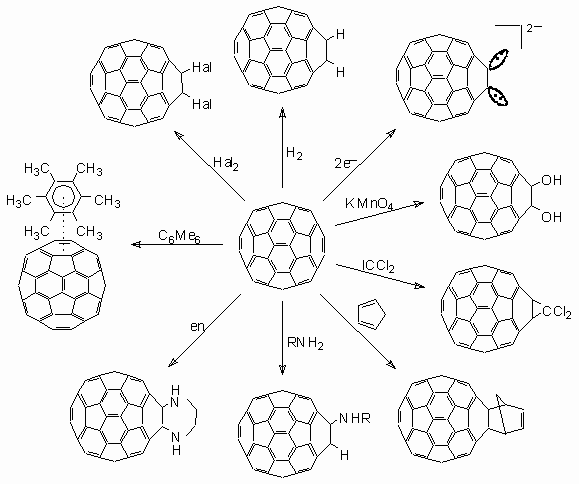
Schulgemäße Reaktionen mit C60
Durch verbesserte Herstellungs- und Isolierungsmethoden ist C60 mittlerweile
auch für Schulen erschwinglich geworden. (Preise siehe unter der Webseite
"Vor den Experimenten zu lesen".) Zur Kostenreduktion kann C60 auch
aus dem wesentlich billigeren fullerenhaltigen Ruß bzw. aus einer käuflichen
Fulleren-Mischung (Fullerit) isoliert werden. Ein Verfahren zur Isolierung von C60 aus Ruß
oder Fullerit auf Schulniveau ist in der Versuchsliste beschrieben.