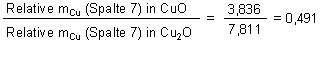
Überprüfung der Gesetze der Massenverhältnisse
Messergebnisse der Reduktion von Kupferoxiden mit Wasserstoff
(Zu den Gesetzen siehe Webseite.)
A Gesetz der konstanten Proportionen (Massenverhältnisse)
1. Beispiel schwarzes Kupfer(II)-oxid (CuO)
Wägeergebnisse (in g)
| 1 | 2 | 3 | |
| Messung | Masse des Schiffchens | Masse des Schiffchens mit CuO | Masse des Schiffchens nach Reduktion mit Cu |
| 1 | 8,476 | 11,648 | 10,987 |
| 2 | 8,807 | 11,719 | 11,124 |
| 3 | 8,361 | 9,416 | 9,197 |
Berechnung der Massen (in g)
| 4 | 5 | 6 | |
| Messung | mCuO
(Spalte 2-1) |
mO
(Spalte 2-3) |
mCu
(Spalte 5-4 oder 3-1) |
| 1 | 3,172 | 0,661 | 2,511 |
| 2 | 2,913 | 0,595 | 2,317 |
| 3 | 1,055 | 0,219 | 0,836 |
| Zum Vergleich
molare Massen (g/mol) |
MCuO
79,55 |
MO
16 |
MCu
63,55 |
Berechnung der Massenverhältnisse
| 7 | 8 | 9 | 10 | |
| Messung | mCu : mO
(Spalte 6/5) |
mO : mCu
(Spalte 5/6) |
mCuO : mO
Spalte 4/5 |
mCuO : mCu
(Spalte 4/6) |
| 1 | 3,798 | 0,263 | 4,799 | 1,263 |
| 2 | 3,894 | 0,257 | 4,896 | 1,257 |
| 3 | 3,817 | 0,262 | 4,817 | 1,262 |
| Durchschnitt | 3,836 | 0,261 | 4,837 | 1,261 |
| Zum Vergleich molare Verhältnisse |
MCu : MO
3,972 |
MO : MCu
0,252 |
MCuO : MO
4,972 |
MCuO : MCu
1,252 |
2. Beispiel rotes Kupfer(I)-oxid (Cu2O)
Wägeergebnisse (in g)
| 1 | 2 | 3 | |
| Messung | Masse des Schiffchens | Masse des Schiffchens mit
Cu2O |
Masse des Schiffchens nach
Reduktion mit Cu |
| 1 | 8,364 | 12,814 | 12,280 |
| 2 | 8,388 | 9,395 | 9,285 |
| 3 | 8,372 | 13,694 | 13,099 |
Berechnung der Massen (in g)
| 4 | 5 | 6 | |
| Messung | mCu2O
(Spalte 2-1) |
mO
(Spalte 2-3) |
mCu
(Spalte 5-4 oder 3-1) |
| 1 | 4,452 | 0,534 | 3,918 |
| 2 | 1,007 | 0,110 | 0,897 |
| 3 | 5,322 | 0,595 | 4,727 |
| Zum Vergleich
molare Massen (g/mol) |
MCu2O
143,1 |
MO
16 |
2 X MCu
2 X 63,55 = 127,1 |
Berechnung der Massenverhältnisse
| 7 | 8 | 9 | 10 | |
| Messung | mCu : mO
(Spalte 6/5) |
mO : mCu
(Spalte 5/6) |
mCu2O : mO
(Spalte 4/5) |
mCu2O : mCu
(Spalte 4/6) |
| 1 | 7,333 | 0,136 | 8,337 | 1,137 |
| 2 | 8,155 | 0,123 | 9,155 | 1,123 |
| 3 | 7,945 | 0,126 | 8,945 | 1,126 |
| Durchschnitt | 7,811 | 0,128 | 8,812 | 1,129 |
| Zum Vergleich
molare Verhältnisse |
2 X MCu : MO
7,944 |
MO : 2 X MCu
0,126 |
MCu2O : MO
8,944 |
MCu2O : 2 X MCu
1,126 |
Nicht vergessen: Bei den molaren Verhältnissen muss man, um sie mit den Messungen vergleichen zu können, die Masse des Kupfers mit 2 multiplizieren.
In einer Verbindung ist das Massenverhältnis der beteiligten Elemente konstant.
Das Massenverhältnis m(Cu) : m(O) ist im schwarzen Kupferoxid immer ungefähr gleich 4 : 1, im roten Kupferoxid 8 : 1.
B Gesetz der multiplen Proportionen (Massenverhältnisse)
1. Kupfer in den beiden Kupferoxiden
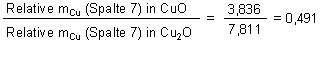 |
» 1 : 2 |
Daraus folgt:
Schwarzes Kupferoxid ist Cu1O1 oder kurz geschrieben CuO
Rotes Kupferoxid ist Cu2O1 oder kurz geschrieben Cu2O
2. Sauerstoff in den beiden Kupferoxiden
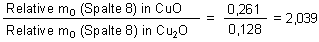 |
» 2 : 1 |
Die Sauerstoffmassen verhalten sich (bezogen auf eine konstante Masse von Kupfer) wie 2 (im schwarzen Oxid) zu 1 (im roten Oxid).
Daraus folgt:
Schwarzes Kupferoxid ist CuO1 oder kurz geschrieben CuO
Rotes Kupferoxid ist CuO1/2 oder anders geschrieben Cu2O
Verbindet sich ein Element mit einem anderen zu mehreren Verbindungen, so stehen die Massen des zweiten Elements im Verhältnis kleiner, ganzer Zahlen.
Das Massenverhältnis m(Cu im schwarzen Oxid) : m(Cu im roten Oxid) ist immer ungefähr gleich 2 : 1. Für das Sauerstoffverhältnis gilt das umgekehrte.
Weitere Texte zum Thema „Sicherheit im Chemiesaal“