
Ein Vorschlag für einen Kurs:
Die quantitativen Gesetze der Chemie im Unterricht
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Zu Beginn wird
Das Gesetz von der Erhaltung der Masse (Lavoisier)
behandelt.
Bei chemischen Reaktionen geht keine Masse verloren.
Noch besser ist es, wenn man zuvor auch in die Bedeutung der chemischen Symbole sowie in die
Herleitung einer chemischen Reaktionsgleichung einführt.
Für den Chemiker ist ein Symbol in einer Reaktionsgleichung mehr als eine international verständliche
Abkürzung. Es ist für ihn immer eine Stoffportion, zunächst ein Atom. Ob er je ein Atom von Zink und
Schwefel reagieren lässt, ob er hundert Atome oder eine Million Atome nimmt: Für den Chemiker ist das egal.
Nur wird für ihn erst bei einer sehr großen Zahl von Atomen der Ansatz wiegbar, weil die Atome so klein sind.
Beschreibt die Reaktionsgleichung Stoffumsätze in Mengen vom Umfange der Loschmidtschen Zahl
6 · 1023, so stehen ein Symbol und eine Formel jeweils für die Stoffportion ein
Mol oder einem Vielfachen davon. So können wir zum Molbegriff überleiten.
Da die Atome verschiedener Elemente sich in ihrer Masse (Atomgewicht) unterscheiden, wird die Rolle
der als Teilchenzahl definierten Stoffportion für die Einwaage von Edukte und die Wägung der Produkte
deutlich. Die Reaktionsgleichung ist somit für den Chemiker Grundlage zur Berechnung von Stoffumsätzen
und damit zur Reaktionsplanung.

Bild 1: Dieses Auto gehört nicht unbedingt einem Chemiker. Es ist vielmehr das Autokennzeichen des
Brandenburger Landkreises Märkisch-Oderland
(Foto: Blume)

Bild 2: Prof. Blume demonstriert die Zinksulfid-Synthese
(Foto: Daggi)
Kann man voraussagen, ob und wie sich die Massen der einzelnen Stoffe
verändern?
Versuch: Demonstration der ZnS-Synthese mit verschiedenen Stoffportionen/Einwaagen:
m(Zn) : m(S) wie 1 : 1 und 1 : 2 und 2 : 1
Ergebnis: Nur der dritte Versuch geht richtig. Warum?
Das Reaktionsschema ist
Zink + Schwefel ———> Zinksulfid + Energie
Wir erinnern uns: Stoffe bestehen aus Atomen. Bei der Reaktion zwischen Zink und Schwefel reagiert ein Atom Zink mit einem Atom Schwefel zu einem Teilchen ("Molekül") Zinksulfid.
Zur Herleitung der Reaktionsgleichung bedienen wir uns mit Kugeln, die die Atome symbolisieren. Satt dessen können wir auch Kreise zeichnen. In diese schreiben wir die Namen der Elemente und der Verbindung. Wir können diese abkürzen und bedienen und dazu der internationalen chemischen Symbole. Dann lassen wir die Kreise weg und erhalten so die bekannte Form einer Reaktionsgleichung.
Zn + S ———> ZnS + Energie
Anhand dieses Vorgehens können wir das Versuchsergebnis deuten.
Es gibt große und kleine Atome oder besser: schwere und leichte Atome.
Die Massen der Atome von Zink und Schwefel verhalten sich offenbar wie 2 : 1.
Gilt das unabhängig von der Gesamtmenge der eingesetzten Stoffe?
Versuch: Reduktion von Kupfer(II)-oxid mit Wasserstoff. (Das schwarze Oxid kennen wir vom Kupferbrief.) Betrachte auch die Messergebnisse zu diesen Versuchen.
Egal, wie viel man vorgibt bzw. einwiegt, das Massenverhältnis m(Cu) : m(O) ist immer gleich 4 : 1. Die folgenden zwei Gesetze wurden zuerst von John Dalton ausgesprochen.
Gesetz von den konstanten Massenverhältnissen
In einer Verbindung ist das Massenverhältnis der beteiligten Elemente konstant.
Versuch: Überprüfen des Gesetzes mit dem zweiten Oxid des Kupfers: rotes Cu(I)-oxid (ebenfalls vom
Kupferbrief her bekannt; nicht zu wenig einwiegen!).
Ergebnis: Das Massenverhältnis m(Cu) : m(O) ist immer gleich 8 : 1.
Daraus entwickeln wir das
Gesetz von den vielfachen Massenverhältnissen
Verbindet sich ein Element mit einem anderen zu mehreren Verbindungen, so stehen die Massen des zweiten Elements im Verhältnis kleiner, ganzer Zahlen.
Also: Das Massenverhältnis m(Cu im schwarzen Oxid) : m(Cu im roten Oxid) ist (bei gleicher Sauerstoffmasse) immer gleich 1 : 2
Statt einer Erklärung: Ein Blick in die Geschichte...
Daltons Postulate/Hypothesen
CuO und Cu2O
Dalton führte auch die relativen Atommassen ein.
Dazu ein Exkurs in die Physik: Wie groß und wie schwer sind die Atome?
Man kann durch sinnvolle Versuche die Masse/das Gewicht der Atome bestimmen.
Sie sind winzig; sie wiegen sehr wenig:
Die Masse eines Wasserstoffatoms ist m(H) = 1,66 · 10-24 g.
Wie viele Atome sind in einem Gramm Wasserstoff enthalten?
Zur Berechnung bilden wir den Kehrwert der Masse eines H-Atoms.
In 1 g Wasserstoff sind abgerundet 6 · 1023 Atome enthalten.
Die Physik zeigt weiterhin: Atome von Sauerstoff sind 16 x schwerer als die von Wasserstoff, wiegen somit 26,56 · 10-24 g. Also sind in 16 g Sauerstoff ebenfalls 6 · 1023 Sauerstoffatome enthalten.
Wir beziehen die Atommassen auf die des Wasserstoffs und erhalten so die von Dalton vorgeschlagenen "relativen Atommassen". Die Atommasse von Wasserstoff setzen wir = 1, die von Sauerstoff ist dann 16. (Heute bezieht man aus Gründen der Messtechnik die Atommassen aller Elemente auf 1/12 der Atommasse des Kohlenstoffs.)
Die Zahl der Atome eines Elements, die in der Stoffportion enthalten sind, die der Atommasse entspricht, ist 6 · 1023. Man nennt diese Stoffportion 1 Mol.
Auf ein Mol bezogene Stoffportionen nennen wir "molar".
Man spricht heute nicht mehr von Atommassen, sondern nur noch von Molmassen.
Den Schülern ist klarzumachen / aus eigenem Erleben zu erzählen:
Chemiker denken bei den chemischen Reaktionen nur in Teilchen. Ob es nun eines
ist, 100 oder 6 · 1023 sind, ist ihnen egal. Ein Mol ist für
sie nur eine bestimmte Zahl von winzigen Atomen oder Molekülen, die einer vernünftig großen Stoffportion entspricht,
die sie in Gramm abmessen können.
Die Gesetze gelten auch für Gase: Avogadros Gesetze
Avogadro nutzte für die Untersuchung der chemischen Grundgesetze statt Massen Gasvolumina.
Nach Wägeversuchen stellte er nämlich fest:
Daraus folgt zwingend:
Versuch: Die Elektrolyse von Wasser in einem Hofmannschen Zersetzungsapparat ergibt stets
v(H2) : v(O2) = 2 : 1
Die Verhältnisformel von Wasser ist also H2O.
2 + 1 = 1 ? oder sogar 2 + 1 = 2 ?
Nun konnte auch aufgeklärt werden, was hinter den merkwürdigen Ergebnissen
steckte, die die Chemiker des beginnenden 19. Jahrhunderts beschäftigte: Man
mischt Wasserstoff und Sauerstoff im Verhältnis 2 : 1, also beispielsweise 200 ml
Wasserstoff mit 100 ml Sauerstoff. Brachte man diese 300 ml Mischung zur Reaktion,
so erwartete man ein Volumen von 100 ml Wasserdampf. Man erhielt aber stattdessen 200 ml.
Die Erwartung fußte auf der damals gültigen Reaktionsgleichung.
2 H + O ———> H2O
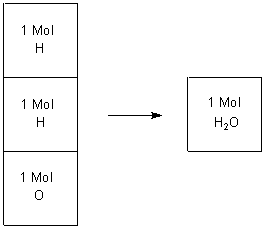
Nahm man aber an, dass die beteiligten Gase aus zweiatomigen Molekülen bestehen, so war das Ergebnis richtig gedeutet.
2 H2 + O2 ———> 2 H2O
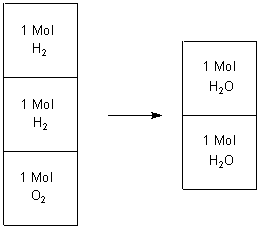
Dabei spielt die Molekülgröße keine Rolle. Denn die Atome sind ja extrem winzig, so dass ein Wassermolekül ähnlich viel Raum einnimmt wie ein Sauerstoffatom. Dazu steht im Gas zwischen den Atomen sehr viel freier Raum zur Verfügung.
Aus dem Molvolumen können wir die Molmasse von Gasen oder von verdampfbaren Stoffen berechnen.
Versuch: Ermittlung der Masse von CO2 durch Gaswägung.
Rückblick
Jetzt können wir auch die chemischen Symbole und Formeln sowie die Reaktionsgleichungen begründen.
Beispiel: Zn + S ———> ZnS + Energie
Ein Element-Symbol steht für
Zum Schluss: Erster Kontakt mit dem Stöchiometrischen Rechnen
Mit Hilfe der quantitativen Gesetze der Chemie kann man bei bekanntem Reaktionsablauf einzusetzende Stoffportionen oder zu erwartende Produktmengen berechnen.
Man will zur Zinksulfidsynthese 10 g Zink umsetzen. Wie viel Schwefel muss man einwiegen, damit die Reaktion optimal abläuft?
Jetzt verstehen wir, warum beim Anfangs-Versuch nur eine Mischung im Massenverhältnis m(Zn) : m(S) = 2 : 1 zum Erfolg führte: Das ist die Kombination von "molaren" Stoffportionen.