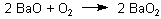
Wie H2O2 hergestellt wird
Experimente:
Versuch: H2O2 aus Bariumperoxid
Veraltetes Verfahren
Wenn man die Oxide von Alkali- oder Erdalkalimetallen mit Sauerstoff umsetzt, erhält man die
entsprechenden Peroxide. Besonders wichtig war das Bariumperoxid.
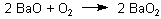
Formal haben wir hier das Bariumsalz der „Wasserstoffperoxidsäure“ vorliegen. Setzen wir das mit einer anderen Säure um, so wird die schwache Säure H2O2 ausgetrieben. Auch das Wasser ist eine Säure, wenn auch eine noch schwächere. Bei Zugabe von Wasser stellt sich ein Hydrolyse-Gleichgewicht ein.
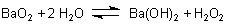
Bei starken Säuren liegt das Gleichgewicht schon weit auf der rechten Seite. Nimmt man sogar verdünnte Schwefelsäure oder Phosphorsäure, so bilden sich Bariumsulfat bzw. –phosphat. Das sind schwerlösliche Salze, die sich abtrennen lassen. Auf diese Weise verschiebt man das oben angezeigte Gleichgewicht völlig nach rechts und erhält mehr oder weniger reines Wasserstoffperoxid.
Moderne Verfahren
Neben der Elektrolyse von Schwefelsäurelösungen, bei denen anodisch Wasserstoffperoxid entsteht
(Klicke hier), nutzt man heute fast ausschließlich das
Anthrachinon-Verfahren.
Das Anthrachinon wird katalytisch in Anthrahydrochinon überführt. Dieses wird unter Druck und erhöhter Temperatur mit Sauerstoff oxidiert, wobei der molekulare Sauerstoff zu Wasserstoffperoxid hydriert wird.
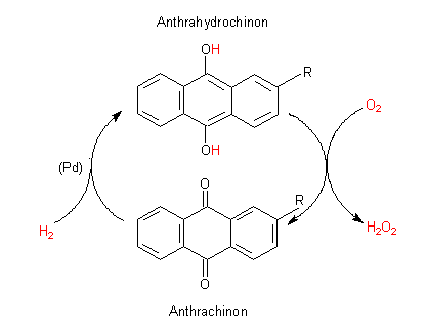
Anthrachinon-Verfahren zur Herstellung von H2O2 (R = Ethyl)
Das Anthrachinon-System spielt also letztlich für folgende Reaktion die Rolle eines Katalysators.
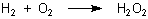
Weitere Texte zum Thema „Wasserstoffperoxid“