Der pH-Wert bestimmt die Aktivität von Enzymen
Experimente:
Versuch: pH-Abhängigkeit der Hydrolyse von Proteinen
Wie alle Proteine sind auch die Enzyme gegen pH-Wert-Änderungen empfindlich. Das
gilt zunächst einmal für die Denaturierung aufgrund extremer pH-Wert-Änderungen,
die den vollständigen (oftmals irreversiblen) Ausfall der Funktion eines Proteins zur
Folge hat. Das ist mit der Überschrift über diese Webseite aber nicht gemeint.
Vielmehr geht es um graduelle pH-Wert-Änderungen in physiologischen Bereichen,
die über die Aktivitäten entscheiden. Dabei kommt es zu keiner Denaturierung. Die
pH-Wertänderungen, längs deren eine reversible Aktivitätsänderung von Null auf das
Maximum zu beobachten ist, liegen innerhalb von 1-2.
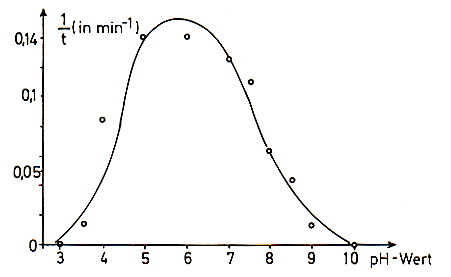
So beobachtet man bei der Amylase bei einem pH-Wert von etwa 6 ein
Aktivitätsoptimum. Man spricht auch von einem pH-Optimum.

pH-Optimum der Amylase [7]
Andere Enzyme zeigen nur eine Wendepunktskurve, die entweder im sauren Bereich oder im alkalischen Bereich liegt. Auch hier nennt man den höchsten Punkt das pH-Optimum. Die Protease Pepsin hat ein pH-Optimum bei pH 2. Das ist vernünftig, denn sie wirkt im sauren Magensaft. Aus dem Pankreas stammt die Protease Chymotrypsin; da sie im alkalisch gepufferten Darmsaft wirkt, hat sie ein pH-Optimum bei 9 (-> Versuch).
Wie sind diese Kurven zu erklären?
Enzyme sind als Proteine wegen ihrer Aminosäurereste selbst Polyelektrolyte,
deren Ladung vom pH-Wert abhängt. Das gilt natürlich auch für das aktive Zentrum
selbst. Dessen Aktivität hängt deshalb vom pH-Wert der Umgebung ab.
Findet man wie bei der Amylase im mittleren pH-Bereich ein pH-Optimum, so kann
dies daher kommen, dass zwei Aminosäurereste an der Katalyse beteiligt, und zwar
der eine in der Säureform, der andere in der Baseform. Das aktive Zentrum zeigt also
die Eigenschaften eines amphoteren Stoffs. Das folgende Bild zeigt diesen
Zusammenhang schematisch.
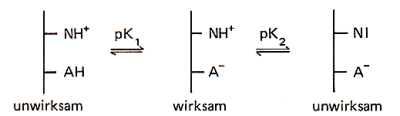
Deshalb kann man diese Kurven mit den Kurven in den Dissoziationsdiagrammen von schwachen Säuren vergleichen.
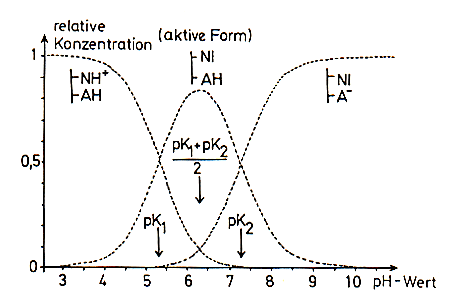
Dissoziationsdiagramm einer zweibasigen schwachen Säure [7]
Es muss aber noch einschränkend darauf hingewiesen werden, dass der pK-Wert in
der engen Umgebung dissoziabler Gruppen in einem Enzym oftmals anders ist als der
der freien Aminosäure. Wir sprechen von Nachbarschaftseffekten.
Das liegt einmal an den Möglichkeiten zur Polarisierung, die die Dissoziation von
Protonen erleichtern oder erschweren kann. Das gleiche gilt für die Basizität von
Basen.
Aber auch Wasserstoffbrücken-Bindungen sind hier als stabilisierend zu nennen.
Dazu kommen noch Komplexbildungen, die auch Wasser plötzlich zu einer stark
wirkenden Säure werden lassen. (Wir kennen das von aprotischen
Säuren wie den Aluminium-Ionen bzw. Aluminium-Aquo-Komplexen.)
Man kann deshalb nicht ohne weiteres aus der Lage des pH-Optimums bzw. der Wendepunkte der pH-Aktivitäts-Kurven eines Enzyms auf die Art der beteiligten Aminosäurereste schließen.
Weitere Texte zum Thema „Katalyse“