
Der Katalysemechanismus des Chymotrypsins
Experimente:
Versuch: pH-Abhängigkeit der Hydrolyse von Proteinen
Chymotrypsin spaltet als Protease hydrolytisch Peptidbindungen. Es ist im
Pankreatin, dem Enzymgemisch der Bauchspeicheldrüse (Pankreas) enthalten (->
Versuch). Dieses Enzym ist eines der ersten gewesen, dessen Mechanismus man
aufgeklärt hat. Wichtig ist, dass der Mechanismus durch ganz normale chemische
Gesetzmäßigkeiten charakterisiert ist.
Das aktive Zentrum des Enzyms enthält die Aminosäurereste von Serin und Histidin.
Das folgende Bild macht deutlich, dass es nicht aus zwei beieinanderliegenden
Aminosäureresten aufgebaut ist, sondern durch zufällige Faltung der Kette
entstanden ist.

Das aktive Zentrum des Chymotrypsins wird im Folgenden nur so weit gezeichnet, wie zur Verdeutlichung des Reaktionsmechanismus notwendig ist. Das gleiche gilt für den Ausschnitt einer Peptidkette, die als Substrat dient. Übrigens zeigt das Enzym eine Spezifität bezüglich der Stelle, an der es als Endopeptidase spaltet. Es hydrolysiert die Peptidbindungen neben den aromatischen Aminosäuren Phenylalanin, Tyrosin und Tryptophan sowie neben Methionin.
Das aktive Zentrum liegt reaktionsbereit vor.
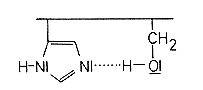
Die folgende Bildreihe zeigt den Ablauf der Hydrolyse-Reaktionen.
Das doppelt gebundene basische Stickstoffatom des Imidazols bildet eine Wasserstoffbrücke zum nahegelegenen Hydroxymethyl-Rest des Serins aus. Damit wird die negative Partialladung am Sauerstoff dieser Gruppe verstärkt. Eine Peptidgruppe nähert sich dem aktiven Zentrum.
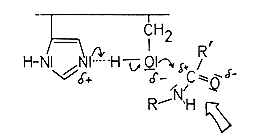
Die Polarisierung erlaubt den Angriff des Serin-Sauerstoffatoms auf das (wegen der Mesomerie der Peptidbindung nur sehr schwach positiv polarisierte) Kohlenstoffatom der Carbonylgruppe der zu spaltenden Peptidbindung. Es kommt zur Ausbildung einer etherartigen Bindung.
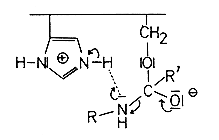
Durch einen Protonenaustausch zwischen Imidazol und dem Stickstoff der Peptidbindung wird diese gespalten. Es bildet sich eine - isolierbare - acylierte Zwischenstufe des Chymotrypsins, ein Ester. Das die Aminogruppe tragende Peptidstück diffundiert ab. Gleichzeitig nähert sich ein Wassermolekül.
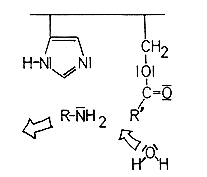
Mit diesem wird der Ester hydrolysiert, wobei der Imidazolrest die Polarisierung des Wassermoleküls durch Bildung einer Wasserstoffbrückenbindung verstärkt.
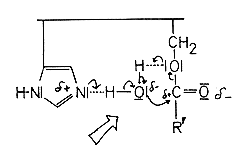
Der Serinester wird also durch den nucleophilen Angriff des polarisierten Wassers gespalten. Danach liegt das Enzym wieder reaktionsbereit vor.
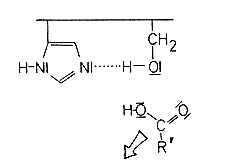
Bei diesem Mechanismus handelt es sich um eine Basenkatalyse, die in zwei Schritten abläuft.
Zusätzlich ist ein in der Nachbarschaft des aktiven Zentrums befindlicher Carboxylat-Rest von Asparagin- oder Glutaminsäure an der Katalysereaktion beteiligt.
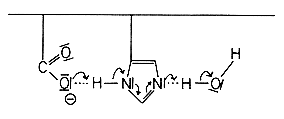
Dieser Rest, der beim physiologischen pH-Wert 7,3 als Carboxylat-Anion vorliegt, verstärkt als Brönsted-Base die katalytische Wirkung des Imidazolrestes, da er das Wasserstoffatom vom Imidazolring zu sich herüberzieht. Das basische Carboxylat-Anion wirkt mit Hilfe einer Reihe von Wasserstoffbrückenbindungen über das Imidazol hinweg so auf ein Wassermolekül ein, dass die negative Partialladung an dessen Sauerstoffatom erhöht wird. Dadurch nimmt die Fähigkeit dieses Wassermoleküls, das Kohlenstoffatom der Carbonylgruppe in der Esterbindung nucleophil anzugreifen, beträchtlich zu. Das betrifft natürlich auch die anderen Reaktionen des Chymotrypsins.
Weitere Texte zum Thema „Katalyse“
Nach [7]