Etwas Stöchiometrie:
Auch bei komplizierten Katalysereaktionen rechnet sich der
Katalysator heraus
Experimente:
Versuch: Blue Bottle (Blaues Wunder)
Methylenblau katalysiert die Oxidation von Glucose durch
Luftsauerstoff. Es handelt sich dabei um zwei Redoxreaktionen, die durch den
Katalyse-Kreisprozess gekoppelt sind.
Rechnet man diese Reaktionen einzeln durch und addiert man sie dann, so entfällt bei
der Gesamtreaktionsgleichung der Katalysator. Das ist ein stöchiometrisch
begründeter Hinweis darauf, dass Katalysatoren unverändert aus der Reaktion, die sie
katalysieren, hervorgehen.
Vorneweg ein Hinweis: Bei der Formulierung der folgenden Reaktionsgleichungen wird nur die Bildung von Gluconsäure berücksichtigt. Dazu kommt noch die Zersetzung des gesamten Glucosemoleküls.
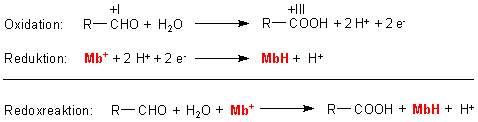
1. Redoxreaktion

Der Sauerstoff, den die Glucose bei ihrer Oxidation einbaut, stammt also redoxneutral
aus dem Wasser und nicht aus der Luft. Das Wasser wird an die Carbonylgruppe
addiert. Die Oxidation des Addukts der Glucose läuft anschließend über
Wasserstoffabspaltung. Das ist für viele biochemische Oxidationen typisch.
Da es sich um Gleichgewichte handelt, entfernt man zur Gleichgewichtsverschiebung
die Protonen. Das erreicht man durch alkalisches Milieu, was wir aus
Vereinfachungsgründen bei der Formulierung der Gleichungen aber nicht
berücksichtigen.
2. Redoxreaktion
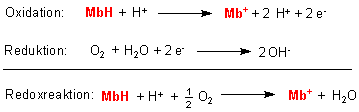
Gesamtreaktion
Nun addieren wir die beiden Gleichungen der Redoxreaktionen.
Daraus folgt mit den Regeln der Algebra:
R-CHO + ½ O2 ———> R-COOH
Wie wir sehen, taucht der Katalysator in der Gesamtbilanz nicht mehr auf.
Weitere Texte zum Thema „Katalyse“