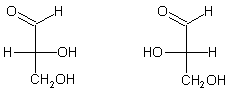
Zur absoluten Raumordnung an asymmetrischen C-Atomen
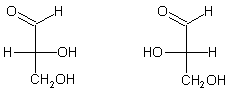
D(+)-Glycerinaldehyd L(-)-Glycerinaldehyd
Folgende Frage stellt sich bei der Betrachtung von Spiegelbild-Isomeren: Woher weiß man eigentlich, bei welcher der beiden Formen die Hydroxyl-Gruppe rechts oder links steht?
Man muss sich das vorstellen: Allen war bewusst, dass es den Unterschied geben musste. Aber man wusste nicht, welche Richtung der Substituenten zu welcher Drehung zuzuordnen war. Man war schlicht ohnmächtig. Was blieb übrig? Zunächst wurde die Stellung der Substituenten willkürlich festgelegt.
Gleich vorneweg: Heute wissen wir, dass der Drehsinn des polarisierten Lichts rein gar nichts mit der absoluten Stellung der vier Substituenten im Chiralitätszentrum zu tun hat. Es war also reiner Zufall, dass die alten Chemiker richtig geraten haben.
Hier ist die Geschichte im Einzelnen:
(Die Daten stammen aus dem Werk von Sieghard Neufeldt [1].)
E. Fischer hat bereits 1894 seine Schreibweise von stereoisomeren Strukturen durch Projektion der Raumformel in die Papierebene vorgelegt [2]. Damit war aber keineswegs geklärt, wie absolute Struktur und Drehrichtung des polarisierten Lichts voneinander abhängen. Sein Musterbeispiel war der d-Glycerinaldehyd. Das d schrieb man damals noch klein und beschrieb damit die Drehrichtung des polarisierten Lichts.
Um der Diskussion ein Ende zu bereiten, welche der beiden Glycerinaldehydformen zu welcher Drehrichtung passte, schlugen A. Wohl und W. Freudenberg 1923 [3] vor, die Raumordnung willkürlich festzulegen. Damit sollten die stereoisomeren Formen des Glycerinaldehyds ihre OH-Gruppe auf die Seite verpasst bekommen, nach der das polarisierte Licht gedreht wird; also d(+) und l(-). Immerhin konnten nun die aus den jeweiligen Glycerinaldehyd-Isomeren synthetisierten reinen Enantiomeren einer neuen Verbindung in eine vernünftige Ordnung gebracht werden. Umgekehrt galt das auch für die Konfigurationen von anderen optisch aktiven Verbindungen, die beim Abbau diese oder jene Glycerinaldehydform ergaben.
Zur Nomenklatur der Stereoisomeren
Später erkannte man, dass die willkürlich festgelegte Konfiguration und der Drehsinn des polarisierten
Lichts nicht zusammenpassten. Ein Beispiel ist die l-Weinsäure, die man aus d-Glycerinaldehyd herstellen
kann. Das zeigt, dass sie beide ein identisch konfiguriertes C-Atom tragen müssen.
Deshalb verzichtete man auf die Buchstaben d und l und führte stattdessen die heute noch vielfach gebräuchlichen Bezeichnungen D und L ein. (Diese Kapitälchen werden normalerweise in kleinerer Buchstabengröße geschrieben: D und L. Darauf verzichten wir hier aber…) Der d-Glycerinaldehyd wurde zu D-(+)-Glycerinaldehyd und die l-Weinsäure zu D-(-)-Weinsäure.
Man muss beim Literaturstudium wissen, dass auch hierüber lange Zeit Uneinigkeit herrschte. So hat Freudenberg die l-Weinsäure noch zur L-(-)-Weinsäure gemacht, wobei er sich wohl auf die obere Hydroxylgruppe bezog. Schließlich war das Chaos auch international perfekt. Angelsächsische Bücher (auch in deutscher Übersetzung) verwendeten noch in den 1960er Jahren andere Bezeichnungen als die deutschen. Um dem aus dem Weg zu gehen, wurde 1966 von R. S. Cahn, C. K. Ingold und V. Prelog ein neues System zur Beschreibung der absoluten Konfiguration vorgeschlagen [4]. Für uns ist hier nur das Ergebnis wichtig:
Der D-(+)-Glycerinaldehyd wurde zur (R)-Form, der L-(-)-Glycerinaldehyd wurde zur (S)-Form.
Die D-(-)-Weinsäure wurde zur (2S,3S)-Form, die L-(+)-Weinsäure zur (2R,3R)-Form.
Die folgende Tabelle zeigt die Entwicklung.
| Chemische Grundverbindung | Glycerinaldehyd | Weinsäure |
| Absolute Struktur der
hier besprochenen Stereoisomeren |
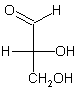 |
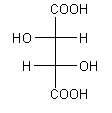 |
| Drehrichtung des polarisierten Lichts | (+) | (-) |
| Bezeichnung nach Fischer | d-Glycerinaldehyd | l-Weinsäure |
| Nicht mehr ganz moderne Nomenklatur,
aber noch gebräuchlich |
D-(+)-Glycerinaldehyd | D-(-)-Weinsäure |
| Moderne Nomenklatur nach Cahn,
Ingold und Prelog |
R-(+)-Glycerinaldehyd | (2S,3S)-(-)-Weinsäure |
Der experimentelle Beweis für die absolute Konfiguration
Erst 1951 konnte die Richtigkeit der 1923 vorgenommenen, willkürlichen Festlegung der Konfiguration
des Glycerinaldehyds bestätigt werden. In diesem Jahr legten J. M. Bijvoet und A. F. Peerdeman
[5] die Ergebnisse einer Röntgenfeinstrukturanalyse vor. Diese
hatten sie an einem Salz der Weinsäure, dem Natrium-Rubidium-(+)-tartrat, vorgenommen.
Warum nahm man ausgerechnet das Rubidiumsalz und warum nicht das bekanntere Kalium-Natrium-(+)-tartrat (Seignettesalz)? Rubidium gehört zu den schweren Metallen; diese wechselwirken besonders stark mit der Röntgenstrahlung (denken Sie ans Blei!) und bilden im Kristallgitter sozusagen Markierungspunkte, von denen aus man die restliche Struktur des Moleküls entschlüsseln kann.
Nur diese Methode erlaubt einen Einblick in die absolute Struktur der Moleküle. Damit hatten die beiden Wissenschaftler zum ersten Mal die absolute Konfiguration einer enantiomeren Verbindung entschlüsselt. Endlich war der Streit um die optischen Isomeren beendet und vom Ruch der Willkürlichkeit befreit worden. Aufbauend auf diesen entschlüsselten Molekülen konnten dann auch alle anderen Konfigurationen zugeordnet werden.
Für die Literatur-Recherche zu dieser Webseite bedanken wir uns bei
StD Dr. Dipl. Chem. Heiner Schönemann
Haarbeckstr. 26
47506 Neukirchen-Vluyn
Literatur:
[1] Sieghard Neufeldt: Chronologie Chemie 1800-1980; VCH, Weinheim 1987.
[2] E. Fischer - Ber. Dtsch. Chem. Ges. 27, 3189 (1894).
[3] A. Wohl, K. Freudenberg - Ber. Dtsch. Chem. Ges. 56, 309 (1923).
[4] Cahn, C. K. Ingold und V. Prelog: Angew. Chem. 78, 413 (1966).
[5] Bijvoet, A. F. Peerdeman et al. – Nature 168, 271 (1951).
Weitere Texte zum Thema „Kohlenhydrate“