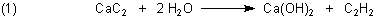
Ohne Kohle keine Carbide
Experimente:
Klicke hier
Carbide sind Verbindungen des Kohlenstoffs mit Elementen, die weniger elektronegativ sind als
Kohlenstoff.
Es gibt nicht nur von den Metallen Carbide, sondern auch von Nichtmetallen. Technisch wichtige Beispiele sind Siliciumcarbid SiC oder die unterschiedlich zusammengesetzten Borcarbide (wie z. B. B12C). Sie sind kovalent aufgebaut.
Ebenfalls kovalente Kohlenstoffverbindungen wie Tetrachlorkohlenstoff CCl4, Schwefelkohlenstoff CS2 oder die Kohlenstoffoxide CO und CO2 zählen nicht zu den Carbiden, weil die Bindungspartner eine größere EN haben als der Kohlenstoff.
Wir wollen uns hier nur mit den Metallcarbiden befassen. Zwei Beispiele sind auch in der praktischen Schulchemie bekannt: Calciumcarbid und Aluminiumcarbid. Sie sind vor allem deshalb wichtig, weil man mit ihnen im Unterricht die Schnittstelle zwischen Anorganischer und Organischer Chemie verdeutlichen kann.
Metallcarbide sind salzartige Verbindungen…
… denn sie sind aus Ionen aufgebaut. Anhand ihrer Anionen kann man Carbide als Salze von mehr oder weniger
fiktiven „Kohlenstoffsäuren“ CnHm, also von Kohlenwasserstoffen auffassen.
Calciumcarbid hat die Formel Ca2C2. Sein Anion ist C22-. Es ist das Salz des Ethins C2H2. Ethin reagiert tatsächlich wie eine Brönsted-Säure, denn es kann Protonen abgeben. So bildet Ethin beim Einleiten in Kupfer(II)-sulfat-Lösungen schwerlösliches Kupfer(II)-carbid. (Klicke hier).
Ethin ist eine schwache Säure. Deshalb hydrolysiert Calciumcarbid, wenn man es in Wasser gibt:
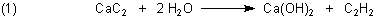
Aluminiumcarbid hat die Formel Al4C3. Sein Anion ist C4-.
Dahinter steht der Kohlenwasserstoff Methan CH4, also keine Säure im Brönstedschen Sinn, denn Methan gibt
unter normalen Bedingungen keine Protonen ab.
Wenn überhaupt, ist Methan eine äußerst schwache Säure. Auch Aluminiumcarbid hydrolysiert deshalb, wenn man es in Wasser gibt:
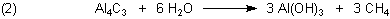
Das weniger bekannte Magnesiumcarbid hat die Formel Mg2C3. Bei seiner
Hydrolyse entsteht aus den Anionen C34- Propan C3H4.
Wie werden Carbide hergestellt?
Carbide werden vor allem durch Reaktion zwischen Koks, also mehr oder weniger reinem Kohlenstoff, und Metallen bzw.
Metallverbindungen hergestellt.
Calciumcarbid wird unter hohen Temperaturen (2000 °C) im Elektroofen aus Kalk und Koks gewonnen:
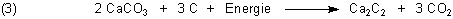
Aluminiumcarbid bildet sich entsprechend aus Aluminiumoxid:
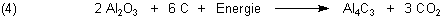
Einschränkend muss man betonen, dass sich auch Carbide bilden, wenn man die glühendheißen Metalle mit
Kohlenwasserstoffen reagieren lässt. Aber dies ist keine Säurereaktion.
Carbide sind übrigens farblos. Wegen der Vermischung mit nicht umgesetztem Kohlenstoff sind sie allerdings grau bis schwarz gefärbt.
Zum Aufbau der Carbide
Die Nichtmetallcarbide sind kovalent aufgebaut.
Die Carbide der Leichtmetalle sind echt ionisch aufgebaut. Welche Zusammensetzung die Carbide haben, also welche Kohlenstoff-Anionen sich bilden, hängt von vielen Faktoren ab. Wichtig sind unter anderem die Größen der Kationen, die über den Aufbau der Kristallgitter entscheiden.
Die unterschiedliche Zusammensetzung der Schwermetallcarbide beruht auch darauf, dass die Kohlenstoffatome auch in Kristallgitterlücken eingebaut werden können. Der Kohlenstoff liegt dann im Metall in einer festen Lösung vor. Man spricht von interstitiellen oder Interkalations-Verbindungen (lat. calathus, Korb). Darunter versteht man Verbindungen, bei denen die Metallatome in kristallografisch genau definierten Lücken des Kohlenstoffgitters (oder umgekehrt) eingebaut sind. Diese legierungsartigen Einlagerungscarbide sind besonders stabil.
Kein Stahl ohne Carbide
Technisch äußert wichtig sind die Nebengruppenmetallcarbide. Sie spielen in der Metallurgie eine
wichtige Rolle. Auch sie entstehen bei der direkten Reaktion zwischen Metall(oxid) und Koks. Das wichtigste ist wohl das
Eisencarbid Fe3C mit dem treffenden Namen Zementit.
Zementit bildet mit Eisen Mischungen, deren Aufbau von der Temperatur und der Abkühldauer abhängt. Beim Erhitzen auf etwa 800 °C wird Zementit in freies Eisen und Kohlenstoff zerlegt. Dieses feste Metall heißt „Austenit“. Wenn man jetzt den Austenit plötzlich abkühlt („abschreckt“), bleiben Eisen und freier Kohlenstoff in Form von Einlagerungscarbiden als feste Lösung nebeneinander erhalten. Der Zustand (genannt „Martensit“) wird quasi eingefroren. Die in einander verfilzten Kristalle der unterschiedlichen „Kristall-Phasen“ verleihen dem so entstandenen Stahl seine bekannte Schmiedbarkeit, Zähigkeit und Festigkeit.