Prof. Blumes Tipp des Monats März 2002 (Tipp-Nr. 57)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Chemie mit Acetylen (Ethin)
Auf Acetylen beruhte einst fast die gesamte organische Chemie der DDR. Irgendwie
scheint für diese Verbindung der "Lack ab zu sein", da man sich nach der Wende
ausschließlich auf petrochemische Edukte gestürzt hat und mit den Umweltschäden
(Staubemissionen und Abwasserproblemen) auch gleich die Acetylenchemie mit
"entsorgt" hat.
Acetylen oder besser Ethin ist immer noch ein faszinierender Stoff. Deshalb wollen wir
heute ein wenig damit experimentieren.
Man stellt es her, indem man Calciumcarbid mit Wasser in Kontakt bringt. Statt
Wasser nehmen manche auch gern Natriumchloridlösung, da sich das Gas darin
weniger löst.
Zur Handelsform von Calciumcarbid sei gesagt, dass das im Allgemeinen mit einem
feinpulvrigen silicatischen Trocknungsmittel verkauft wird. Das sollte man natürlich
nicht nehmen, sondern die darin verborgenen steinartigen Carbidbröckchen... Das hat
schon mancher unerfahrener Referendar zu seinem Leidwesen erfahren müssen.
Mit diesem Tipp wollen wir auch beginnen, mehr auf Themen aus der organischen
Chemie einzugehen.
 |
| Bild 1: Apparatur zum Herstellen von Ethin
(Foto: Daggi) |
|
Versuch 1: Herstellung von Ethin Keine offenen Flammen, gut lüften! In einer Gasentwicklungsapparatur wird aus einem Tropftrichter vorsichtig Wasser auf
Calciumcarbid (F) gegeben. Die Wassermenge regelt man nach der Gasbildung. Nicht
zuviel Wasser auf einmal zugeben, da sich das System so stark erhitzen kann, dass
es sich selbst entzündet.
|
Die Gleichung der exothermen Bildungsreaktion ist:
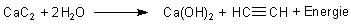
Das gilt nicht für alle Carbide; so reagiert Aluminiumcarbid Al4C3 unter Bildung von
Methan. Das liegt daran, dass die Kristallgitter des Calciumcarbids bereits von
vornherein C22--Ionen enthalten, während im Gitter des Aluminiumcarbids einzelne
C4--Inseln zu finden sind.
Übrigens riecht wirklich reines Acetylen etwas aromatisch-süßlich. Der typische
"Carbidgeruch" dagegen stammt von Phosphinen, also
Phosphorwasserstoffverbindungen wie PH3. Diese sind auch der Grund für leichte
Selbstentzündung des Gases bei seiner Herstellung. (Man kennt sie als Flämmchen im
Sumpfgas, die zur Legende von den Moorgeistern beigetragen haben.) Phosphine
stammen aus der Reaktion von Wasser mit Calciumphosphid. Letzteres wiederum entsteht durch
Reduktion aus Phosphat, das als Verunreinigung in den Rohstoffen für die Carbidherstellung,
Kalk und Kohle, enthalten ist.
Zunächst untersuchen wir das Brennverhalten von Ethin. Schließlich dient es ja als Brennstoff beim Betrieb eines Schweißbrenners.
|
Versuch 2: Brennprobe mit Acetylen Auf keinen Fall den ersten Zylinder nehmen, denn er kann Acetylen-Knallgas enthalten! Wir entzünden ein Stöckchen, öffnen den Deckel des Glaszylinders und halten die Flamme an das Gas. Es entzündet sich und verbrennt unter starkem Rußen. |
 |
| Bild 2: Abbrennen von Acetylen
(Foto: Daggi) |
Diese Probe zeigt nicht gerade, dass Ethin mit heißer Flamme verbrennt. Das kann
man mit Acetylen-Knallgas zeigen. Die Mischung Ethin/Sauerstoff übertrifft die des
Wasserstoff-Knallgases bei weitem... Unser Versuch zeigt aber, warum man Ethin unter
anderem auch gezielt zur Rußgewinnung verbrannt hat. Denn die Rußentwicklung ist
erstaunlich.
Von Interesse sind auch die Additionsreaktionen von Ethin.
|
Versuch 3: Addition von Brom an Ethin
|
Es wird nur wenig Brom addiert. Das verwundert, da aufgrund der Dreifachbindung ein starker Bromverbrauch zu erwarten ist. Die geringe Neigung zur Addition liegt daran, dass die C-Atome im Acetylen stärker elektronegativ sind als im Ethen und deshalb ihre Elektronen nicht so gern an elektrophile Substanzen wie das den Angriff einleitende Bromkation Br+ abgeben. Man kann auch sagen, dass das an der energetisch besonders günstigen Ladungsverteilung der Elektronen der Dreifachbindung liegt. Denn die sind rotationssymmetrisch angeordnet.
Dagegen verläuft die Reaktion zwischen Ethin und Chlor spektakulärer.
|
Versuch 4: Reaktion zwischen Ethin und Chlor
|
Aus Kaliumpermanganat und Salzsäure bildet sich Chlor in radikalischer Form, das mit dem gleichzeitig entstehenden Ethin reagiert.
KMnO4 + 8 HCl ———> KCl + MnCl2 + 5/2 Cl2 + 4 H2O
Das entweichende Gasgemisch entzündet sich immer wieder von selbst unter Bildung stark rußender Flammen.
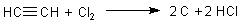
 |
| Bild 3: Reaktion zwischen Ethin und Chlor. Die Bilder wurden
im Abstand von 3 Sekunden gemacht
(Foto: Daggi) |
Acetylen reagiert auch mit sodaalkalischer Kaliumpermanganat-Lösung (Baeyer-Probe).
|
Versuch 5: Baeyer-Probe mit Ethin
|
Hier gibt es nicht so sehr eine Addition, sondern eine echte Redoxreaktion. Acetylen ist nämlich ein gutes Reduktionsmittel. Seine diesbezügliche Oxidationsgleichung ist
C22- ———> 2 C + 2 e-
 |
| Bild 4: Reaktion von Ethin mit dem Baeyer-Reagenz
(Foto: Daggi) |
Als Oxidationsmittel sollten auch Silber-Ionen wirken. Hierbei entsteht neben
metallischem Silber und Kohlenstoff auch eine Silber-Kohlenstoffverbindung,
Silbercarbid oder besser: Silberacetylid Ag2C2. Der
Name sagt schon, dass es sich hierbei um ein Salz handelt. Da dieses im
trockenen Zustand sehr explosiv ist, müssen wir beim Umgang damit einiges beachten.
|
Versuch 6: Ethin reagiert mit Silber-Ionen
|
Ethin ist eine Säure mit allerdings nur sehr schwach ausgeprägten sauren Eigenschaften.
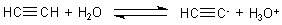
Das zeigt sich schon in der Bildungsreaktion von Ethin aus Calciumcarbid und Wasser! Denn die beruht ja nur darauf, dass das Salz einer schwachen und zugleich flüchtigen Säure (Ethin) durch eine stärkere Säure (hier Wasser) ausgetrieben wird. Diese Protolysereaktion führt dann auch zu der alkalischen Reaktion der Lösung.
|
Versuch 7: Alkalische Reaktion der Carbid/Wasser-Mischung
|
Das Silberacetylid bildet sich nur aufgrund des stark alkalischen Milieus und weil es außerdem
ein schwerlösliches Salz ist.
Dieses Salz hat es in sich. Es gehört zu den Initialzündern. Ähnlich wie
Silberazid kann es, wenn es richtig trocken ist,
durch Schlag gezündet werden. Es ist dann sogar so empfindlich, dass man zerstreutes
Acetylid auch mit einem Handfeger zünden kann. Lustig ist es, wenn man Reste auf dem Boden
ausstreut. Dann knistert es, wenn die Reinemachekräfte mit dem Besen
darüberfegen...
Warum explodiert es überhaupt? Denn Calciumcarbid oder Aluminiumcarbid sind
unempfindlich und können auch durch starkes Erhitzen nicht zur Explosion überredet
werden. Der Grund liegt in der katalytischen Wirkung von Schwermetall-Ionen.
Deshalb gibt es auch den gleichen Effekt mit Kupfer- oder Bleiacetylid.
Übrigens darf man nicht zuviel von Schwermetallacetylid herstellen und auch nichts aufbewahren. Also: Mengen über 1 g sind tabu. Denn dann kommt man mit dem Sprengstoffgesetz in Konflikt.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 09. Februar 2011, Dagmar Wiechoczek