| Name | Abkürzung | Formel |
| Ethylendiamin | en | 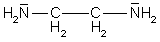 |
| Dimetylglyoxim | dmg | 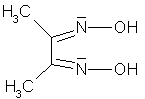 |
| Ethylendiamin-tetraessigsäure | edta | 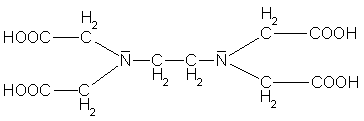 |
Was sind Komplexe?
Komplexe sind chemische Verbindungen, bestehend aus einem Zentralteilchen (Atom bzw. Ion) und Liganden (ligare (lat.) = binden), die sich um das Zentralteilchen in einer bestimmten geometrischen Form anordnen. Die Anzahl der direkt am Zentralteilchen gebundenen Atome übersteigt in der Regel dessen Oxidationszahl.
Bei dem Kupfer(II)-sulfat-Pentahydrat
[Cu(H2O)4]SO4 · H2O
ist das Kupfer(II)-Ion das Zentralteilchen, das vier Wasser-Liganden quadratisch-planar an sich bindet. Das fünfte Wassermolekül ist über Wasserstoffbrücken an das Sulfat-Ion gebunden und spielt bei der eigentlichen Komplexbindung keine Rolle.
Die eigentliche Komplexeinheit, bestehend aus Zentralteilchen und Liganden, wird zur besseren Verdeutlichung in eckige Klammern gesetzt. Ist diese Einheit geladen, so spricht man auch von einem Komplex-Ion, das zusammen mit entsprechenden Anionen oder Kationen Komplexsalze bildet.
Beim [Cu(H2O)4]SO4 · H2O bildet also das Sulfat-Ion das entsprechende Anion zum positiv geladenen Komplex-Ion. Beide Ionen bilden zusammen das Komplexsalz.
Das Zentralteilchen
Bei den Zentralteilchen handelt es sich am meisten um positiv geladene Metall-Ionen.
Dabei trifft man häufig auf Ionen der d-Block-Elemente,
die so genannten Übergangsmetalle. Beispiele hierfür sind Eisen, Kupfer, Cobalt, Nickel
oder Silber.
Es gibt aber auch einige sehr bedeutende Komplexe mit Ionen der Hauptgruppenmetalle wie
Magnesium, Calcium oder Aluminium.
Sogar ungeladene Metallatome können als Zentralteilchen fungieren, wie
etwa das Nickel im Carbonylkomplex [Ni(CO)4].
Es existieren auch Komplexe, die nicht nur ein Zentralteilchen besitzen.
Dabei schließen sich zwei oder mehrere Metall-Ionen zu einer Art Cluster
(cluster (engl.) = Haufen) zusammen. Solche Clusterkomplexe
sind relativ selten, aber sehr bedeutend für die Biologie und für die Katalysatorentechnik.
Die Liganden
Die Zahl der direkt an das Zentralteilchen gebundenen Atome nennt man
Koordinationszahl (coordinare (lat.) = beiordnen).
Sie kann zwischen 2 und 12 liegen. Komplexe mit niedrigen (< 4)
und hohen (> 6) Koordinationszahlen (KZ) sind selten anzutreffen,
wohingegen die mittleren (4-6) Koordinationszahlen häufig vorkommen.
Unter den Liganden gibt es einzähnige oder mehrzähnige. Als einzähnige Liganden
kommen sowohl einatomige wie auch mehratomige Ionen und Moleküle in Frage.
Häufige Liganden sind z. B.
| Formel | H2O | NH3 | F- | Cl- | OH- | CN- | SCN- |
| Name | Aqua | Ammin | Fluoro | Chloro | Hydroxo | Cyano | Thiocyanato |
Mehrzähnige Liganden nennt man Chelate
(chelae (lat.) bzw. chele (griech.) = Krebsschere). Sie sind mit mindestens zwei
Atomen gleichzeitig an das Zentralteilchen gebunden und legen sich scherenartig um dieses herum.
Chelatkomplexe sind meist viel stabiler als Komplexe mit einzähnigen Liganden.
Als Beispiele für Chelatbildner wären zu nennen:
| Name | Abkürzung | Formel |
| Ethylendiamin | en | 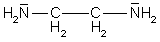 |
| Dimetylglyoxim | dmg |  |
| Ethylendiamin-tetraessigsäure | edta | 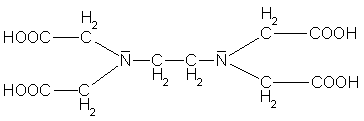 |
Die Bindung
Als Komplexbindung kommen alle Übergänge zwischen ionisch und kovalent in Frage. Im letzteren Fall erfolgt die
Bindung zwischen Liganden und Zentralteilchen über ein gemeinsames Elektronenpaar.
Dieses Paar stammt vom Liganden. Demnach lassen sich Zentralatom und Ligand als Lewis-Säure
und Lewis-Base beschreiben. Komplexverbindungen sind sozusagen die Salze der
Lewis-Säure/Base-Theorie. Solche Bindungen nennt man auch koordinativ.
Weitere Texte zum Thema „Komplexverbindungen“