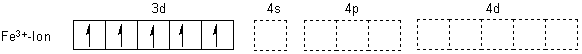
Nicht bei allen Komplexen werden die Innenschalen aufgefüllt
Es gibt stabile und weniger stabile Komplexe. Das hat auch etwas damit zu tun, wie weit die inneren Orbitale aufgefüllt werden. Das kann man bei den folgenden beiden Eisen(III)-Komplexen zeigen.
Beide haben die Koordinationszahl 6, tragen also sechs Liganden und sind deshalb oktaedrisch aufgebaut. Während der Cyanokomplex sehr stabil ist, gilt das nicht für den Aquakomplex, den man zum Beispiel durch Erwärmen leicht zerstören kann.
Beide Komplexe beruhen auf der Elektronenkonfiguration des Eisen(III)-Ions.
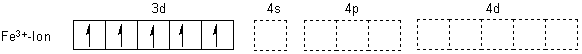
Bei den Komplexen gibt es jedoch Unterschiede.
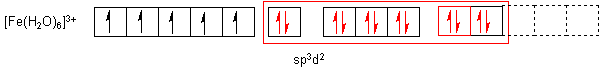
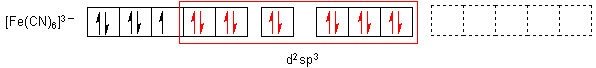
Im ersten Fall besetzen die nichtbindenden Elektronenpaare des Liganden (Wasser)
äußere Orbitale, ohne die 3d-Orbitale zu tangieren. Im zweiten Fall schieben die
Liganden (Cyanid-Ionen) die Elektronen der d-Schale zusammen. (Nach dem
Angelsächsischen spricht man hier vom Outer-orbital-Komplex
sowie vom Inner-orbital-Komplex.)
Dadurch gibt es auch verschiedene Möglichkeiten zur Hybridisierung der sechs
Ligandenorbitale. Beim Aquakomplex liegen sechs gleichwertige sp3d2-Orbitale vor,
beim Cyanokomplex sechs gleichwertige d2sp3-Orbitale. Man sieht ein, dass die
ersteren Orbitale weiter ausladend sind; somit sind die Liganden weiter weg vom
Zentralteilchen und nicht so fest gebunden. Wir sprechen hier von einem
Anlagerungskomplex. Der andere Komplextyp heißt Durchdringungskomplex.
Weil es immer wieder Nachfragen gibt: Was ist der Unterschied zwischen
den Hybridorbitalen d2sp3 und sp3d2?
Bei der Benennung von Hybridorbitalen kommt es auf die Reihenfolge der Besetzung der an der
Hybridisierung beteiligten Orbitale an.
Beispiel: Fe3+-Komplexe mit sechs Liganden. Halten wir uns an die obige Abbildung.
Im ersten Fall, dem Low-spin- oder Durchdringungskomplex, rücken die vorhandenen fünf Elektronen in drei Orbitalen der 3d-Schale zusammen. Die 12 Ligandenelektronen füllen die restlichen freien zwei 3d-Orbitale, anschließend das leere 4s- und die drei leeren 4p-Orbitale auf. Es gibt dann kompliziert gebaute Hybridorbitale zwischen den äußeren zwei 3d- sowie dem 4s-Orbital sowie den drei 4p-Orbitalen. Man schreibt das 3d24s4p3 oder kurz d2sp3.
Beim zweiten Typ, dem High-spin- oder Anlagerungskomplex, bleiben alle 3d-Orbitale halbbesetzt, also halbleer. Die fünf Elektronen rücken nicht zusammen. Die 12 Ligandenelektronen müssen sich deshalb nicht nur auf die anschließenden 4s- und 4p-Orbitale verteilen, sondern auch auf zwei aus dem 4d-Bereich ausweichen. Es gibt dann kompliziert gebaute Hybride zwischen dem 4s- sowie den drei 4p-Orbitalen sowie zwei 4d-Orbitalen. Man schreibt das 4s4p34d2 oder kurz sp3d2.
Paramagnetische Eigenschaften der Komplexe
Es gibt noch eine wichtige Eigenschaft, aufgrund deren die Komplextypen
unterschieden werden können. Das sind ihre magnetischen Eigenschaften. Der Outer-orbital-Komplex ist stark
paramagnetisch, der inner orbital-Komplex dagegen zeigt diese Eigenschaft nur in geringem Umfang.
Unter Paramagnetismus versteht man die Eigenschaft, dass sich eine Probe in einem
Magnetfeld längs der Feldlinien ausrichtet. Ursache hierfür sind die
Spins der rotierenden Elektronen. Die Richtung ihrer Drehmomente wird durch die Pfeile angezeigt.
Im Anlagerungskomplex liegen viele einsame und somit parallel ausgerichtete Elektronen vor; es gibt
deshalb starke Wechselwirkungen mit dem Magnetfeld. Es ist ein
High-spin-Komplex. Je mehr ungepaarte Elektronenspins vorliegen, desto stärker
ausgeprägt ist der Paramagnetismus. So kann man die Zahl der parallel
ausgerichteten Einzelelektronenspins förmlich zählen.
Der schwach paramagnetische Durchdringungskomplex ist dagegen ein
Low-spin-Komplex. Denn die Spins seiner Elektronen heben sich bezüglich der
Wechselwirkung mit dem magnetischen Feld (fast alle) gegenseitig auf.
Beispiele aus der Biologie
In Lebewesen gibt es viele Eisenkomplexe und entsprechend viele Beispiele für Low- oder High-spin-Komplexe.
So ist der Hämoglobinkomplex mit Sauerstoff
Hb-Fe2+-O2 ein Anlagerungskomplex. Deshalb ist der Sauerstoff leicht ablösbar und
dringt auch nicht so stark zum Zentralteilchen vor, als dass er dem Eisen(II)-Ion ein
Elektron entreißen könnte. Das wäre fatal, denn der Komplex Hb-Fe3+-O2 ist ein
Durchdringungskomplex, der sein Sauerstoffmolekül nicht mehr so leicht abgibt.
Durchdringungskomplexe sind auch Hb-Fe2+-CN- und Hb-Fe2+-CO, ein Grund für die
Giftigkeit der Cyanid-Ionen und von Kohlenstoffmonoxid.
Wie man erklären kann, dass einige Liganden die Elektronen der d-Schale zusammendrängen und andere nicht, ist schwerer zu verstehen. Hierzu haben wir eine Webseite für Experten.
Weitere Texte zum Thema „Komplexverbindungen“