Tetraedrisch oder quadratisch-planar?
Die Strukturen von Kupfer(II)-Komplexen
Die Kupfer(II)-Komplexe mit den Liganden (L) Ammoniak (bzw. Wasser) und mit
Cyanid-Ionen binden beide vier Liganden: Tetraamminkupfer(II) [Cu(NH3)4]2+
(bzw. Tetraaquakupfer(II) [Cu(H2O)4]2+) sowie Tetracyanocuprat(II)
[Cu(CN)4]2-. Die sehen alle ähnlich aus. Jedoch sind ihre geometrischen
Strukturen unterschiedlich. Ammoniakmoleküle (bzw. Wassermoleküle) ordnen sich quadratisch-planar
um das Kupfer(II)-Ion und die Cyanid-Ionen tetraedrisch.
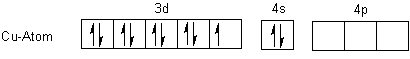
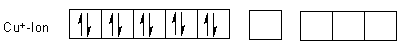
Schauen wir uns die Orbitale an. Das Kupferatom steht in der 9. Nebengruppe und
hat somit 9 Elektronen im 3d-Orbital sowie 2 im 4s-Orbital.

Das Kupfer(II)-Ion hat die 4s-Elektronen abgegeben.
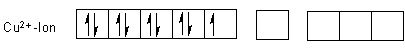
Mit vier Ammoniakmolekülen bildet sich ein Komplex mit folgender Elektronenkonfiguration, wobei das Einzelelektron herausgedrängt wird:
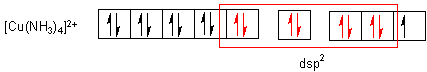
Die dsp2-Hybridorbitale sind quadratisch-planar ausgerichtet.
Mit vier Cyanid-Ionen ist die Elektronenkonfiguration anders. Hier bleibt das Einzelelektron in der d-Schale.
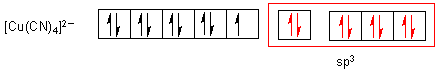
Es bilden sich vier tetraedrisch angeordnete sp3-Hybridorbitale.
Offenbar dringen die Cyanid-Ionen nicht so tief in das Kernfeld ein wie die ungeladenen Liganden Ammoniak und Wasser. Es ist auch daran zu denken, dass sich die Liganden in einem Tetraeder mehr voneinander entfernen als in einem Quadrat. Man kann aber nicht generell von vornherein sagen, ob dieser oder jener Ligand eher zur Auffüllung der inneren Schalen führt. Das sehen wir ganz besonders bei den Eisen-Komplexen.
Übrigens gibt es auch vom Kupfer(I) einen Tetraammin-Komplex: [Cu(NH3)4]+. Dieser ist jedoch tetraedrisch aufgebaut.
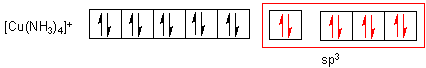
Weitere Texte zum Thema „Komplexverbindungen“