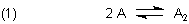
Dimerisierungsgleichgewichte
Dimerisierung ist die Reaktion zwischen zwei identischen Teilchen (Monomere) unter Bildung eines Assoziats (Dimere).
Die Bindung zwischen den Monomeren kann unterschiedlich stark sein.
Hier sind einige Beispiele
1 Cyclopentadien dimerisiert spontan in einer exothermen, intermolekularen Diels-Alder-Reaktion
zu Dicyclopentadien.
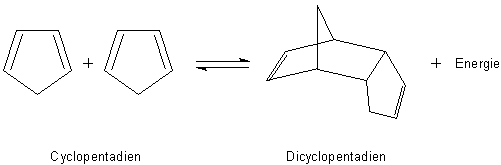
Bild 1: Dimerisierung von Cyclopentadien
Die Dimerisierung erfolgt so rasch, dass man, wenn man Cyclopentadien benötigt, dieses erst durch Erhitzen
des Dimeren herstellen muss ("Retro-Diels-Alder-Reaktion"). Das Monomere ist nur gekühlt mehrere
Tage stabil. Klicke zum Beispiel hier. Die Bindung ist kovalent.
2 Carbonsäuren dimerisieren in unpolaren Lösemitteln wie Benzol oder Toluol. Aber auch in
ihren Kristallen liegen sie als Dimere vor. Darüber berichten wir hier. Die
Bindung beruht auf Wasserstoffbrücken.
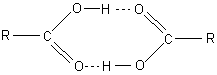
Bild 2: Dimeres von Carbonsäuren
Im Allgemeinen ist die Dimerisierung eine Gleichgewichtsreaktion
Die Lage des Gleichgewichts beschreibt man wie üblich mit einer Konstanten. Die heißt hier Dimerisierungskonstante.
Man muss aufpassen, wie die formuliert wird. (Das ist so ähnlich wie bei den Komplex-Konstanten…)
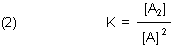
Letztlich ist das eine reziproke Dissoziationskonstante, wie wir sie von Säuren her kennen.
Bei der Dimerisierungskonstanten ist jedoch bemerkenswert, dass die Konzentration der beiden Monomeren A gleich ist, das Gleichgewicht also nicht weiter durch die Monomerenkonzentration zu steuern ist. Dagegen handelt es sich bei einer Säuredissoziation um zwei verschiedene Stoffe (Anion und Proton bzw. Hydrogenium-Ion), über deren jeweilige Konzentration das Gleichgewicht getrennt steuerbar ist.
Mit der Randbedingung
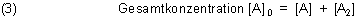
Dazu muss man die folgende quadratische Gleichung z. B. für [A] lösen.
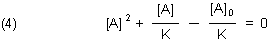
Das machen wir mit der aus mathematischen Tafelwerken *) her bekannten p/q-Formel.
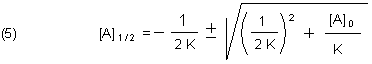
Hier ist nur der positive Wurzelwert physikalisch sinnvoll. Sonst gäbe es ja eine negative Konzentration!
Zur Überprüfung dieses Ergebnisses bringen wir ein Rechenbeispiel: Wir setzen K = 1 und [A] 0 = 1.
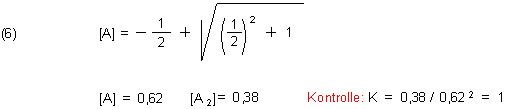
Dadurch, dass wir die Konzentration gleich 1 setzten, erhalten wir als Ergebnis relative Konzentrationen. Das heißt, dass wir auf diese Weise leicht die Werte für beliebige Konzentrationen berechnen können. Wir müssen die berechneten Relativwerte nur mit dem jeweiligen [A]0 multiplizieren.
Man kann natürlich auch umgekehrt bei Kenntnis der Konzentrationen [A] und [A2] die Gleichgewichtskonstante berechnen. Die Konzentrationen ermittelt man z. B. über spektroskopische Messungen. Denn bei Dimerisierungen treten oftmals typische spektroskopische Veränderungen auf, die man zur quantitativen Auswertung nutzen kann.
*) Zum Beispiel: Das große Tafelwerk interaktiv. Cornelsen Volk und Wissen-Verlag. Berlin 2007
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“