Prof. Blumes Tipp des Monats September 2008 (Tipp-Nr. 135)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.

Bild 1: Professionelle Bestimmung eines Schmelzpunkts.
Der feine Stab oberhalb der Apparatur im linken Bild ist die Kapillare, die den zu schmelzenden Stoff enthält
(Foto: Daggi)
Zum Schmelzpunkt der gesättigten Carbonsäuren
Immer wieder bekomme ich Anfragen zu den Schmelzpunkten von gesättigten Carbonsäuren:
|
“Gibt es eine chemische bzw. physikalische Erklärung für den (meiner Meinung nach sehr unregelmäßigen) Verlauf der Schmelztemperaturen? Bei den Siedetemperaturen ist hingegen erkennbar, dass diese mit steigender Länge des Alkylrestes ansteigt. Mein Chemielehrer konnte die Frage nicht beantworten und durch Literaturrecherche wurde ich auch nicht fündig.“ |
Der folgenden Tabelle kann man die entsprechenden Temperaturwerte entnehmen.
Eigenschaften von Carbonsäuren
| Chemische Bezeichnungen | Trivialnamen | Zahl der C-Atome | Schmelzpunkte
(°C) |
Siedepunkte
(°C) |
| Methansäure | Ameisensäure | 1 | 8,4 | 100,5 |
| Ethansäure | Essigsäure | 2 | 16,6 | 118 |
| Propansäure | Propionsäure | 3 | -22 | 141 |
| Butansäure | Buttersäure | 4 | -5 | 162,5 |
| Pentansäure | Valeriansäure | 5 | -34,5 | 187 |
| Hexansäure | Capronsäure | 6 | -1,5 | 205,5 |
| Heptansäure | Önanthsäure | 7 | -11 | 223,5 |
| Octansäure | Caprylsäure | 8 | 16,5 | 237 |
| Nonansäure | Pelargonsäure | 9 | 12,5 | 254 |
| Decansäure | Caprinsäure | 10 | 31,5 | |
| Undecansäure | 11 | 28 | ||
| Dodecansäure | Laurinsäure | 12 | 44 | |
| Tridecansäure | 13 | 43 | ||
| Tetradecansäure | Myristinsäure | 14 | 54,5 | |
| Pentadecansäure | 15 | 52,3 | ||
| Hexadecansäure | Palmitinsäure | 16 | 63 | |
| Heptadecansäure | 17 | 61 | ||
| Octadecansäure | Stearinsäure | 18 | 69 |
Zu den Temperaturen sei etwas angemerkt: Man findet durchaus unterschiedliche
Temperaturwerte, wenn man verschiedene Literaturquellen zu Rate zieht. Kleine Abweichungen von 1-2
Grad sollte man tolerieren. Was allerdings die Leute von www.swissmilk.de geritten hat, die
folgenden Werte zu veröffentlichen, war mir zunächst ein Rätsel. Erst dachte ich an einen Umrechnungsfehler
(z. B. Grad Fahrenheit in Celciusgrade). Aber auch das erklärt nicht, was Sie hier lesen können.
|
Physikalische Eigenschaften
|
Beim Vergleich mit den richtigen Werten (-5 / +69 / -11 °C) fällt auf, dass es sich bei dem
Temperaturfehler um den Faktor 10 handelt. Das sieht nach einem Übertragungsfehler aus: Da hat offenbar
jemand beim Abschreiben des Manuskripts ein Grad-Symbol (°) für eine Null (0) gehalten!
Nun zurück zum Thema. Trägt man die richtigen Schmelztemperaturen gegen die Zahl der C-Atome auf, erhält man eine Graphik, die unsere Tabellenwerte illustriert.
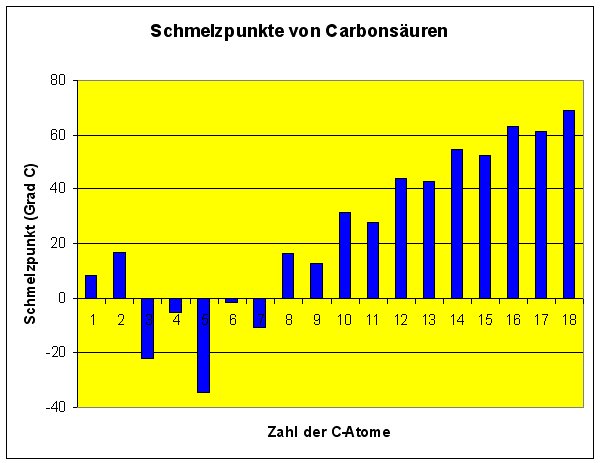
Bild 2: Schmelzpunkte der Carbonsäuren
Es wird deutlich, dass die Schmelztemperatur einer ungeradzahligen Carbonsäure stets niedriger liegt
als die der zuvor stehenden geradzahligen Carbonsäure... Allerdings werden diese Unterschiede mit zunehmender
Kettenlänge weniger deutlich.
Grundsätzlich gilt, dass Schmelzpunkte einer Substanz stets in erster Linie eine Frage des Aufbaus des Kristallgitters sind. Dabei spielen auch die Strukturen der den Kristall aufbauenden Moleküle (die Gitterbausteine) eine Rolle. Erst in zweiter Linie spielt auch die Molmasse eine Rolle. Das wird bei den Carbonsäuren nicht anders sein.
Die Struktur der Gitterbausteine
Aus kryoskopischen Daten wie der Gefrierpunktserniedrigung (bei der
man natürlich statt mit Wasser mit Fettlösemitteln arbeiten muss und wobei man stets die doppelte Molmasse erhält)
und aus Strukturanalysen mit Röntgenstrahlen weiß man, dass Carbonsäuren
als Dimere vorliegen. Die Ursache ist die Ausbildung von Wasserstoffbrücken zwischen den
Carboxylgruppen, so dass die Moleküle „Kopf an Kopf“ liegen.
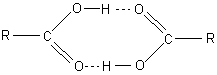
Bild 3: Wasserstoffbrücken bei den Carbonsäuren
Somit ordnen sich die Moleküle zunächst einmal paarweise an. Wir zeichnen das abgekürzt so:
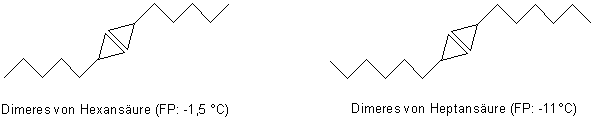
Bild 4: Dimere von Carbonsäuren
Diese Dimere gruppieren sich im Kristallgitter in charakteristischer Art und Weise. Grund: Ihre
Alkylketten sind lipophil und werden durch van der Waals-Kräfte zusammengehalten. Das stabilisiert
das Gitter. Dies hat eine besonders enge Nachbarschaft der Alkylketten zur Voraussetzung, denn bei den
van der Waals-Kräften handelt es sich um ausgeprägte Nahordnungseffekte. Was wir erwarten ist: Je
länger die Ketten sind, desto höher sollte auch der Schmelzpunkt liegen. Es sieht aber ganz anders aus!
Offenbar gibt es strukturelle Unterschiede, die nicht von der Masse, sondern von der Kettenlänge, also von der Zahl der C-Atome abhängen. Wir wollen sehen, woran das liegen könnte.
Was ist der Grund für den Zickzack-Verlauf der Schmelzpunkte?
Hier ist zunächst ein Blick ins Gitter einer geradzahligen Carbonsäure (Hexansäure). Die
endständigen Methylgruppen überlappen sich. Achtung: Das sieht in der Graphik zwar wie eine Doppelbindung aus,
ist aber keine!
Wenn sich die endständigen Methylgruppen nicht überlappen würden, könnte der Kristall nicht zusammenhalten. Denn die van der Waals-Bindungen beruhen auf ausgeprägten Nahordnungskräften.
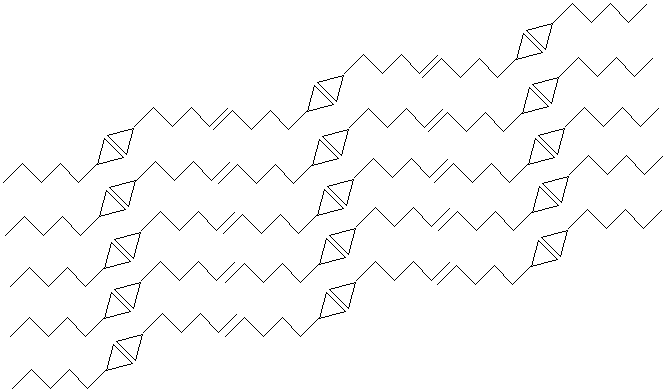
Bild 5: Kristallgitter einer geradzahligen Carbonsäure (Hexansäure)
Nun ein Blick ins Gitter einer ungeradzahligen Carbonsäure (Heptansäure). Die
endständigen Methylgruppen überlappen sich auch hier.
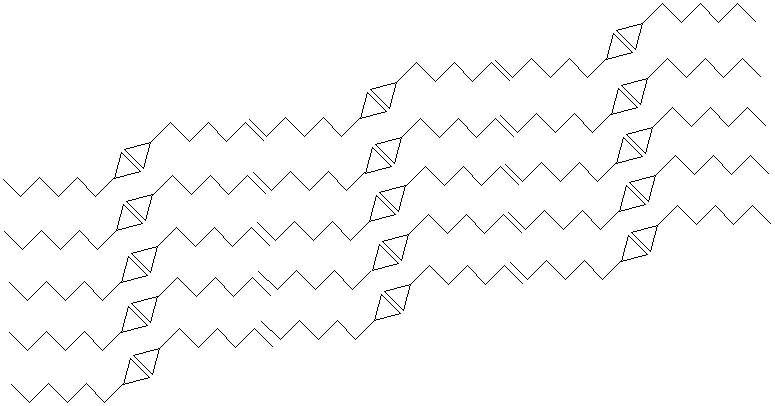
Bild 6: Kristallgitter einer ungeradzahligen Carbonsäure (Heptansäure)
Auf den ersten Blick gleichen sich die beiden Gitter. Aber bei genauem Hinsehen erkennt man, dass
bei den geradzahligen Carbonsäuren die Ketten so liegen, dass die doppelbindungsartigen
Überlappungen der endständigen Methylgruppen fast in der Achse der Dimerenketten liegen.
Bei den ungeradzahligen Carbonsäuren ist das nicht der Fall. Hier steht die Kontaktstelle der beiden Methylgruppen nahezu senkrecht zur Achse der Dimerenketten. Aus dieser Stellung resultiert insgesamt ein geringerer Überlappungseffekt. Die Methylgruppen stören sich eher. Die Gitter sind nicht mehr so dicht gepackt. Die van der Waals-Kräfte zwischen den Alkylketten sind geringer, und die Ketten kleben nicht so stark aneinander. Das heißt: Es ist weniger Energie nötig, um die Ketten voneinander zu lösen. Der Schmelzpunkt ist deshalb bei ungeradzahligen Carbonsäuren geringer.
Dieser Unterschied macht sich mit zunehmender Kettenlänge immer weniger bemerkbar, so dass die Temperaturdifferenzen nicht mehr so deutlich ausfallen (siehe Graphik in Bild 2 oben).
Wenn erst einmal alles geschmolzen ist, machen sich nur noch die Kettenlänge und damit die Molmasse als Steuergrößen bemerkbar. Deshalb steigen die Siedepunkte der Carbonsäuren wie bei homologen Verbindungen gewohnt kontinuierlich an.
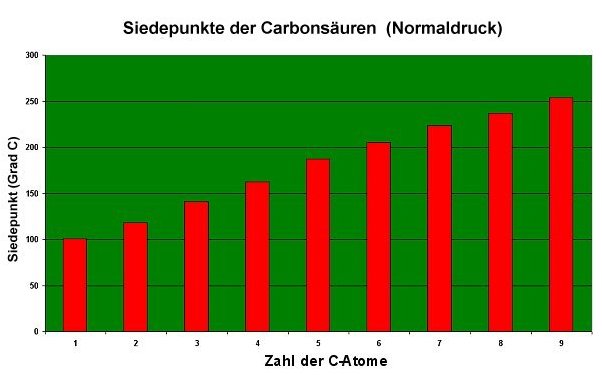
Bild 7: Siedepunkte der Carbonsäuren
Die Schmelzpunkte ungesättigter Carbonsäuren liegen deutlich unter 0 °C. Bei deren Schmelzverhalten spielen die cis-Doppelbindungen eine wichtige Rolle. Dazu haben wir eine Webseite.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 25. August 2008, Dagmar Wiechoczek