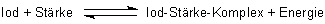
Der Iod-Stärke-Komplex
Experimente:
Versuch: Temperaturabhängigkeit der Bildung des Iod/Stärke-Komplexes
Der wechselseitige Nachweis von Iod und löslicher Stärke (Amylose) beruht auf der
Bildung einer tiefblauen Einschlussverbindung, dem so genannten Iod-Stärke-Komplex. Die Reaktion
ist ein chemisches Gleichgewicht.
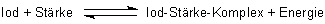
Da die Bildung des Komplexes exotherm ist, wird durch Erwärmen die endotherme Rückreaktion, die Dissoziation des Komplexes in seine Edukte, begünstigt (-> Versuch). Beim Abkühlen bildet sich der Komplex zurück. Dies ist wieder ein schönes Beispiel für das Prinzip von Le Chatelier.
Der Grund für die Farbigkeit des Komplexes liegt nicht in der kettenförmigen Anordnung von vielen Jodatomen in den Spiralen der Amylose - auch wenn das immer gerne als Modell herangezogen wird.
Genau genommen handelt es sich beim eingelagerten Iod um Polyiodid-Anionen wie zum Beispiel [I5]-, das sich aus Iodid-Ionen und 2 Iodmolekülen bildet.
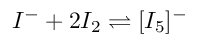
Zunächst muss man wissen: In wässriger Lösung liegt Iod gar nicht molekular als I2 vor. Denn die Iodmoleküle sind in Wasser kaum löslich. Zur Erhöhung der Löslichkeit wird Iod mit Kalium-Iodidlösung vermischt ("Lugolsche Lösung"). Darin sind verschiedenste Iod-Iodidkomplexe wie [I3]- oder [I5]- vorhanden.
Das [I5]--Ion ist ein lockeres, gewinkeltes Assoziat von zwei Iodmolekülen
an ein zentrales Iodid-Ion. Aufgrund der ungleichen Bindungsabstände der 5 Iodatome ist anzunehmen,
dass bereits dieses Iod/Iodid-Assoziat ein Charge-Transfer-Komplex ist. Iodid ist Elektronendonator.
Die Elektronen des Komplexes sind leicht anregbar. Daher resultiert die dunkelbraune Farbe, was auch
auf das Vorliegen vieler unterschiedlicher Spezies hinweist. Diese absorbieren in den unterschiedlichsten
Spektralbereichen. (Braun ist bekanntlich eine typische Mischfarbe.)
Darüber hinaus kann auch Stärke als Donator-Molekül fungieren, was nochmals zu einer Farbvertiefung,
diesmal aber einheitlich in Richtung auf Blau, führt.
Beim Erwärmen kommt die Anordnung aufgrund der Molekülschwingungen nicht zustande, deshalb bleibt die blaue Farbe aus.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“