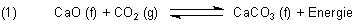
Zur Unabhängigkeit der Gleichgewichtskonstanten vom Druck
Probleme schafft immer wieder die Unabhängigkeit der Gleichgewichtskonstanten vom Druck.
Man muss Folgendes unterscheiden:
| - | Der Wert der Gleichgewichtskonstanten
K ist nur von T abhängig und nicht von p und auch nicht von den Konzentrationen. Ändert
man unter Konstanthaltung der Temperatur (isotherm) durch Zugabe oder Entnahme die Konzentration
eines Reaktionspartners, so verschiebt sich das Gleichgewicht durch Neu- oder Rückbildung der anderen
Komponente derart, dass der für die jeweilige Temperatur gültige Wert von K wieder erreicht wird.
|
| - | Anders ist es mit der Lage des Gleichgewichts, also der Schwerpunkt einer Reaktionsgleichung. Die ist von der Temperatur, dem Druck und Konzentrationen der Reaktanden abhängig. Hier greift somit das Gesetz von Le Chatelier. |
Bei isotherm geführten Gasreaktionen ist die Gleichgewichtslage vor allem vom Druck abhängig. Man kann auch sagen, dass die Druckangabe eine Konzentrationsangabe beinhaltet.
Beispiel:
Die Reaktion des Kalkbrennens
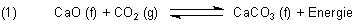
wird durch Erhöhung des Drucks (was einer Erhöhung der CO2-Konzentration entspricht) nach Rechts verschoben. Das heißt: Es wird so lange CO2 an CaO gebunden, bis der Wert der Konstante wieder der gleiche ist wie vor der Gleichgewichtsstörung.
Bitte beachten: Es gibt bei Gasreaktionen zwei Wertangaben für die Konstante: Kc und Kp, die sich numerisch unterscheiden. Erstere enthält die Konzentrationsangaben in mol/l, die andere als Partialdrücke.
Es ist schwierig, sich selber Gleichgewichte zu basteln und durch scheinbar logische Zahlenvariation die Konstanten zu berechnen. Hier ist ein beeindruckendes Beispiel aus dem Lehrbuch Charles E. Mortimer: Chemie. Das Basiswissen. Thieme-Verlag.
Es geht um folgendes Gleichgewicht:
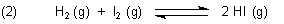
Folgende vier Versuchsansätze werden bei 425 °C gefahren:
- Reines HI wird erhitzt.
Dann dasselbe mit Mischungen von
- H2 und I2
- H2 und HI
- H2, I2 und HI
(Diese Mischungen lassen sich mit spektroskopischen Methoden analysieren.)
Nach Einstellen der vier Gleichgewichte findet man in jedem der vier Töpfe (wie zu erwarten war) alle drei Reaktanden, aber mit jeweils unterschiedlichen Konzentrationen.
Setzt man deren Konzentrationswerte in das Massenwirkungsgesetz ein, so erhält man - was viele erstaunt! - in allen vier Fällen den gleichen Wert für Kc (bzw. Kp) bei 425 °C.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“