
Das Massenwirkungsgesetz und die Gleichgewichtskonstante
Bei Substanzen, die untereinander zu einer reversiblen chemischen Reaktion befähigt sind, stellt sich nach einer gewissen Zeit ein dynamischer Zustand ein, bei dem die Konzentrationen aller Reaktionspartner untereinander in einem bestimmten Verhältnis stehen. Das beschreibt das so genannte Massenwirkungsgesetz. Darunter versteht man den Quotienten aus dem Produkt der Konzentrationen der Stoffe, die an der Rückreaktion beteiligt sind, und dem Produkt der Konzentrationen der Stoffe, die an der Hinreaktion beteiligt sind. Der Quotient ist eine Konstante, die Gleichgewichtskonstante K.

Wie schreiben wir die Reaktionsgleichungen?
Welche Reaktionsrichtung aus dem Gleichgewichtsgeschehen man zur
Formulierung des Massenwirkungsgesetzes rechts und welches man links schreibt,
ist eine Frage der Konvention. Steht bei den schwachen Säuren die Dissoziation
und bei den schwerlöslichen Salzen die Bildung gelöster Ionen im Vordergrund des
Interesses, so gilt das Umgekehrte für Komplexe. Hier definiert man mit dem
Massenwirkungsgesetz keine Dissoziationskonstante, sondern deren Kehrwert, die
Stabilitätskonstante.
Beispiele für die Formulierung des Massenwirkungsgesetzes
Betrachten wir zum Beispiel eine Säure/Base-Reaktion wie die Dissoziation von
Essigsäure (HAc) beim Lösen in Wasser.
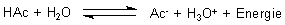
Hier ist das Massenwirkungsgesetz
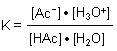
Das Lösungsgleichgewicht eines schwerlöslichen Salzes wie zum Beispiel Bleiiodid beschreibt die folgende Reaktionsgleichung.
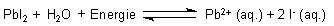
Das Massenwirkungsgesetz ist dann:
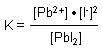
Stöchiometrische Faktoren gehen also als Potenzzahlen der Konzentrationstherme ein.
Zur Formulierung des Massenwirkungsgesetzes sei noch darauf hingewiesen, dass man Konzentrationswerte für feste Phasen, die (bis auf den Bereich an den Phasengrenzen, an denen die Reaktionen ablaufen) aus der Gleichgewichtsreaktion ausgeschieden sind, nicht berücksichtigt. So schreibt man das Massenwirkungsgesetz für die Dissoziation von Bleiiodid
L = [Pb2+] · [I-]2
Diese Konstante heißt Ionenprodukt oder Löslichkeitsprodukt.
Ähnlich verfährt man auch, wenn eine Substanz in großem Überschuss vorliegt. Das
ist z. B. bei der Eigendissoziation des Wassers der Fall. Hier wird die
Konzentration des Wassers in die Konstante einbezogen.
Warum man die Konstanten logarithmiert
Viele Zahlenwerte von K sind unhandliche Zehnerpotenzen. Zum Beispiel beträgt
die Dissoziationskonstante der Essigsäure bei 25 °C 1,76 · 10-5. Man logarithmiert
sie deshalb und definiert
-log K = pK
Die Dissoziationskonstante einer schwachen Säure nennt man pKs-Wert. Für Essigsäure beträgt er 4,75. Er ist der pH-Wert, bei dem die Konzentration von undissoziierter Säure und ihres Anions gleich sind.
Welche Dimension hat die Gleichgewichtskonstante?
Man kann darüber streiten, ob man die Gleichgewichtskonstante mit einer
Dimension versieht oder ob man sie dimensionslos lässt. Für letzteres spricht, dass
man die Konstante sonst nicht logarithmieren könnte. Der Chemiker übrigens
benutzt im Massenwirkungsgesetz statt der Konzentrationsangaben in mol/l lieber
die dimensionslosen Aktivitäten und bei Gasen die entsprechenden Fugazitäten.
Die Gleichgewichtskonstante ist temperaturabhängig
Durch Temperaturerhöhung verschiebt man das Gleichgewicht in die Richtung des
"endothermen Verlaufs", bei Abkühlung entsprechend in die entgegengesetzte
Richtung. Beim Dissoziationsgleichgewicht der Essigsäure würde man beim
Erwärmen eine Abnahme der Dissoziation beobachten, bei einer gesättigten Lösung von Bleiiodid eine Zunahme der
Löslichkeit, d. h. das Verschwinden des in der Kälte ungelösten Bodenkörpers.
Die Gleichgewichtskonstante ist unabhängig von den Konzentrationen und
vom Druck
Verändert man die Konzentrationen der am Gleichgewicht beteiligten Stoffe, so läuft
die Reaktion in der Richtung ab, die zur Wiederherstellung des Werts der
Gleichgewichtskonstante führt. Gibt man zum Beispiel zu einer Essigsäurelösung
eine starke Säure, so erhöht man die Konzentration der H3O+-Ionen. Entsprechend
muss deshalb eine gewisse Menge an Acetat-Ionen unter Erhöhung der
Essigsäurekonzentration verbraucht werden. Gibt man andererseits zu einer
gesättigten Lösung von Bleiiodid Kaliumiodid, so fällt vermehrt Bleiiodid aus. Der Wert der Konstanten ist
also unabhängig von den Konzentrationen der Reaktanden.
Bei Gleichgewichtsreaktionen, an denen Gase beteiligt sind, gilt analoges für den Druck, denn bei Gasen sind Druck und Konzentration austauschbar (Stichwort: Partialdruck). Die Gleichgewichtskonstante ist also auch nicht druckabhängig.
Dabei muss man jedoch beachten: Wenn man bei Gasen statt der mol/l-Konzentrationen Partialdrücke verwendet, bekommt die Gleichgewichtskonstante numerisch einen anderen Wert. Man unterscheidet deshalb zwischen Kc und Kp.
Zur Druckabhängigkeit von Gleichgewichten klicken Sie hier. Dort bringen wir auch ein Beispiel für die Auswirkung der Variation von Reaktandenkonzentrationen auf die Konstante eines Gasgleichgewichtssystems.
Der Wert der Gleichgewichtskonstante wird durch einen Katalysator nicht
beeinflusst
Die Anwesenheit eines Katalysators nimmt keinen Einfluss auf die
Gleichgewichtslage und damit auch nicht auf den Wert der
Gleichgewichtskonstante. Katalysatoren bewirken nur eine Veränderung der
Geschwindigkeit, mit der sich Gleichgewichte einstellen.
Die Größe von K sagt etwas über die Vorzugsrichtung der
Reaktionen aus
1 Das gilt zunächst einmal für die Gleichgewichtslage. Wenn K = 1 ist, sind
Rückreaktion und Hinreaktion gleichberechtigt.
Wenn K einen großen Wert hat, liegt das Gleichgewicht weitgehend auf der rechten
Seite der Reaktionsgleichung. Die Hinreaktion ist gegenüber der Rückreaktion
bevorzugt.
Bei einem kleinen Wert von K ist die Rückreaktion bevorzugt.
2 Weichen die Konzentrationswerte im Massenwirkungsgesetz von ihren Gleichgewichtswerten ab, ist das Gleichgewicht gestört. Das Massenwirkungsgesetz definiert nun keine Gleichgewichtskonstante mehr, sondern den Reaktionsquotienten Q, in den man statt der Gleichgewichtskonzentrationen die aktuellen Konzentrationen einträgt. Die Stoffe des Reaktionsgemischs werden nun so lange miteinander reagieren, bis Q den Wert von K erreicht hat. Dann stellt sich der bekannte Zustand eines dynamischen Gleichgewichts ein.
Die Herleitung des Massenwirkungsgesetzes
ist auf zwei Wegen möglich. Darüber berichten wir auf zwei gesonderten Webseiten.
1 Die kinetische Herleitung des Massenwirkungsgesetzes
2 Die thermodynamische Begründung des Massenwirkungsgesetzes und DG
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“