Prof. Blumes Tipp des Monats April 2002 (Tipp-Nr. 58)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Bleiiodid ist gelb
Welche Farbe hat aber eine gesättigte Bleiiodidlösung?
 |
| Bild 1: Blühende Krokusse in der Sonne
(Foto: Daggi) |
Draußen wird es Frühling, Blumen blühen in allen Farben. Besonders Krokusse zeigen ein
prächtiges sattes Gelb. Da fällt einem Chemiker nichts Besseres als Bleiiodid ein. Darüber wollen
wir heute sprechen, auch wenn Bleisalze giftig sind. Man kann aus der Beschäftigung mit
ihnen eine Menge Chemie lernen.
Zunächst müssen wir für die Versuche etwas Bleiiodid herstellen. Dazu gibt man Lösungen von einem Bleisalz und Kaliumiodid zusammen. Es fällt aus den zuvor farblosen Lösungen ein sattgelber Niederschlag aus: Bleiiodid.
Pb2+ + 2 I- ———> PbI2 + Energie
Die Reaktion ist exotherm. Der Effekt ist allerdings so gering, dass wir im Schullabor keine Temperaturerhöhung messen können.
 |
| Bild 2: Bleiiodid (Foto: Daggi) |
|
Versuch 1: Herstellen von Bleiiodid
|
Mit der zur Herstellung von Bleiiodid abfiltrierten Lösung, der Mutterlauge, kann man ein Phänomen beobachten: Gibt man überschüssige Kaliumiodidlösung zum farblosen Filtrat, fällt noch mehr Bleiiodid aus!
|
Versuch 2: Nachfällung von Bleiiodid
|
Es fallen noch einmal erstaunlich große Mengen an Bleiiodid aus. Und das geschieht, obwohl man
kein weiteres Bleisalz zugegeben hat. Man kann also durch Zugabe von überschüssigem
Kaliumiodid die Ausbeute an Bleiiodid erhöhen. Das nennt man Nachfällung.
Das Phänomen kann nur damit erklärt werden, dass bei unserem Versuch zur Herstellung von
Bleiiodid nicht alle Blei-Ionen und Iodid-Ionen miteinander unter Bildung von Bleiiodidkristallen
reagiert haben, sondern in Lösung geblieben sind. Es hat sich ein chemisches Gleichgewicht
zwischen festem Bleiiodid und seinen Ionen (Pb2+ und I-) ausgebildet.
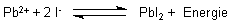
Dieses Gleichgewicht liegt immer dann vor, wenn man Kristalle schwerlöslicher Verbindungen in Wasser gibt. Dann gibt es nämlich gesättigte Lösungen, aus denen heraus Ionen ständig Kristalle aufbauen und gleichzeitig wieder in Lösung gehen. Es ist ein dynamisches Gleichgewicht.
So ein Gleichgewicht kann man offenbar verschieben. Das ist eine Anwendung von Le Chateliers Prinzip des kleinsten Zwangs: Übt man auf ein Reaktionssystem einen Zwang aus, so weicht es so aus, dass die Auswirkungen des Zwangs minimiert werden.
Zunächst untersuchen wir Verschiebung des Löslichkeitsgleichgewichts durch Erwärmen. Das sollte möglich sein, da die Bildungsreaktion von Bleiiodid aus seinen Ionen exotherm ist.
|
Versuch 3: Temperaturabhängigkeit der Löslichkeit von Bleiiodid
|
 |
| Bild 3: Bleiiodidkristalle in einer gesättigten Lösung
(Foto: Daggi) |
Das Gleichgewicht verschiebt sich also beim Erwärmen nach links:
Pb2+ + 2 I- <——— PbI2 + Energie
Merkwürdigerweise ist die gesättigte Gleichgewichtslösung farblos. Das ist aber nicht verwunderlich: In der Lösung befinden sich ja nur Blei- und Iodid-Ionen, und die sind farblos. Bleiiodid ist nur als Festkörper sattgelb. Der Grund ist, dass die Blei-Ionen die Elektronenschale der großen, voluminösen Iodid-Ionen so beeinflussen, dass sie schon durch sichtbares Licht angeregt werden können. Sie absorbieren aus dem Weiß also blaues Licht und strahlen gelbes zurück.
Nun aber zu der Nachfällung: Man kann Löslichkeitsgleichgewichte auch durch Variation der Konzentrationen der Reaktionspartner verschieben.
|
Versuch 4: Verschiebung des Gleichgewichts durch Konzentrationsänderung
|
In diesem Fall verschiebt sich das Gleichgewicht nach rechts.
Pb2+ + 2 I- ———> PbI2 + Energie
Wie wir sehen, geht das mit beiden Reaktionspartnern. Man spricht hier von gleich-ionigen
Zusätzen.
(Anmerken wollen wir aber, dass sich die Niederschläge von Bleiiodid in Farbe und Konsistenz
unterscheiden, je nachdem, welches Salz man im Überschuss dazu gibt.
Das liegt daran, dass die Kationen oder Anionen die Kristallisation von Bleiiodid beeinflussen.
Hier spielen vor allem Oberflächeneffekte und Komplexbildungsreaktionen des Blei(II)-Ions
eine Rolle.)
Der Effekt der Gleichgewichtsverschiebung durch gleich-ionige Zusätze lässt sich quantitativ untersuchen. Das Gleichgewicht wird nämlich mit Hilfe einer speziellen Konstante beschrieben, dem Löslichkeitsprodukt. Darunter versteht man das Produkt aus den Konzentrationen der beteiligten Ionen, hier Pb2+ und I-. Man spricht auch vom Ionenprodukt.
L = [Pb2+] · [I-] · [I-] = 1,4 · 10-8
Es leitet sich von der normalen Gleichgewichtskonstante her, indem man die Konzentration (besser: Aktivität) des ungelösten Rückstands gleich 1 setzt. Dahinter steckt die Überlegung, dass es gleich ist, ob man 5 g Festkörper oder 50 g im Glas hat.
Diese Gleichgewichtskonstante hängt nur von der Temperatur ab. Das haben wir ja im Versuch 3 gesehen. Gibt man nun zu der gesättigten Lösung eine bestimmte Menge an Iodid, so muss sich die Menge an Blei-Ionen entsprechend verringern. Nur so behält das Löslichkeitsprodukt seinen konstanten Wert. Hier ist es komplizierter, weil auf ein Blei-Ion zwei Iodid-Ionen kommen. Die Konzentrationen werden nicht addiert, sondern multipliziert. Verdoppelt man also die Iodid-Konzentration, so sinkt die vom Blei auf ein Viertel der Gleichgewichtskonzentration.
L = [Pb2+]/4 · 2 [I-] · 2 [I-] = 1,4 · 10-8
Der Wert der Gleichgewichtskonstanten bleibt erhalten. Das kann aber nur über Ausfällen von Bleiiodid erfolgen. Dies ist für die Reinigung von mit Schwermetallen belasteten Abwässern wichtig.
Übrigens gibt es noch einen weiteren Weg, Bleiiodid herzustellen. Das gelingt über eine Festkörperreaktion. Die hat aber den Nachteil, dass man mit festen Bleisalzen arbeiten muss, dessen Staub giftig ist.
|
Versuch 5: Herstellen von Bleiiodid im Mörser
|
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 12. August 2008, Dagmar Wiechoczek