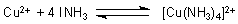
Ammoniak und Amine sind Lewisbasen und Komplexliganden
Experimente:
Versuch: Bildung des Tetraamminkupfer(II)-Komplexes
Versuch: Bildung des Bis(ethylendiamin)kupfer(II)-Komplexes
Der Säure/Base-Begriff hat viele Wandlungen durchgemacht. Für das Ammoniaksystem war
die Theorie von Brönsted sehr hilfreich. Hiermit konnten Protonierung
des Ammoniaks und der Amine sowie die alkalische Reaktion ihrer wässrigen Lösungen erklärt
werden.
Stoffe, die ein freies Elektronenpaar tragen, werden als Lewis-Basen bezeichnet. Sie reagieren mit Stoffen, die eine Elektronenlücke haben, mit den Lewis-Säuren. Die Produkte der Lewis-Säure/Base-Reaktion sind die Komplexe.
Das trifft alles auf das Ammoniak und die Amine zu. Eine ihrer typischen Reaktionen ist
die Komplexbildung. Ammoniak und Amine sind Komplexliganden. Grund dafür
ist das freie Elektronenpaar, mit dem sie sich in die Elektronenschalen anderer Atome oder
Ionen einklinken können. Bekannt ist die Reaktion von Ammoniak mit Kupfer(II)-Salzlösungen.
Die Reaktion ist so typisch, dass man sie sogar gern als Nachweisreaktion für Kupfer(II)-Ionen
nutzt. Bei Zugabe von Ammoniaklösungen bildet sich der tiefblaue Kupfertetraammin-Komplex
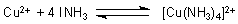
Der Komplex ist quadratisch planar aufgebaut.

Lösung mit dem Tetraamminkupfer(II)-Komplex
(Foto: Sandra)
Genau genommen handelt es sich bei dieser Reaktion um einen Ligandentausch, denn das Kupfer(II)-Ion liegt in wässriger Lösung als Tetraaquo-Komplex vor.
Amine, die mehrere funktionelle Gruppen tragen, können auch Chelate bilden. Ein Beispiel ist das Ethylendiamin (abgekürzt en).
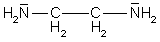
Weitere Texte zum Thema „Ammoniak, Amine und Säure-Amide“