Ammoniak und Wasser - Beide sind Dipole
Experimente:
Versuch: Der biegsame Wasserstrahl
Die Moleküle von Ammoniak sind, ebenso wie die des Wassers, permanente Dipole. Anders als
beim Wasser (-> Versuch) können wir das im Versuch
aber nicht zeigen, da Ammoniak bei Zimmertemperatur ein Gas und außerdem ein ätzender Gefahrstoff
ist.
Um den Dipolcharakter zu verstehen, müssen wir uns den Aufbau der Moleküle anschauen. Fangen wir mit dem Wasser an.

Wassermolekül (Quelle: Cornelsen)
Die Struktur des Wassermoleküls: Das EPA-Modell
Sauerstoffatome besitzen sechs Valenzelektronen. Zur Bindung im Wassermolekül stellen die zwei
Wasserstoffatome zwei weitere Valenzelektronen zur Verfügung. So bleiben vier Elektronen als zwei
nichtbindende Elektronenpaare übrig.
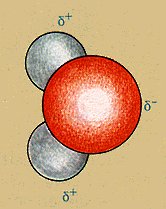
Bezüglich der Anordnung dieser vier "Orbitale" gibt es zwei Möglichkeiten: Sie könnten um das Sauerstoffatom herum ein flaches Quadrat oder ein räumliches Tetraeder ausbilden.
Alternative Strukturen des Wassermoleküls
Vergleicht man beide Strukturen, so erkennt man, dass sich die Elektronenwolken beim Quadrat näher kommen als beim Tetraeder. Sie stoßen sich deshalb besonders ab. Beim Tetraeder dagegen ist die Abstoßung minimal. Das besagt das einfache Elektronenpaar-Abstoßungsmodell ("EPA"). Das beste Modell hierfür sind die vier Luftballons.

Luftballons als Orbitalmodell
(Foto: Nerge)
Versuche, mit dem Ballonmodell auch ein Quadrat zu bauen.
Der Winkel zwischen H-O-H ist allerdings nicht genau ein Tetraederwinkel, da die nichtbindenden Elektronenpaare größere Orbitale bilden als die bindenden. Deshalb werden die bindenden Elektronenpaare und damit auch die Wasserstoffatome etwas "zusammengedrückt". Der Winkel beträgt somit statt 109,5° nur 104,5°.
Ähnlich verhält es sich mit dem Ammoniak-Molekül
Stickstoffatome haben fünf Valenzelektronen, von denen drei zur Bindung mit den drei Wasserstoffatomen,
die jeweils ein Valenzelektron mitbringen, genutzt werden. Zwei Elektronen bleiben als ein nichtbindendes
Elektronenpaar zurück.
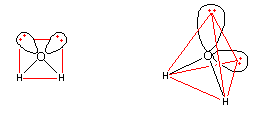
Auch hier gibt es bezüglich der Anordnung dieser vier "Orbitale" wieder zwei Möglichkeiten: Sie könnten um das Stickstoffatom herum ein flaches Quadrat oder ein räumliches Tetraeder ausbilden.
Ammoniakmolekül
Nach dem Elektronenpaar-Abstoßungsmodell erkennen wir, dass sich auch hier die Elektronenwolken beim Quadrat näher kommen als beim Tetraeder. Somit ist das Tetraeder die wahrscheinlichste räumliche Anordnung der Atome, da es die größtmöglichste Entfernung und damit die minimale Abstoßung zwischen den Elektronen gewährleistet.
Der Winkel zwischen H-N-H ist auch hier nicht genau ein Tetraederwinkel, da die nichtbindenden Elektronenpaare größere Orbitale bilden als die bindenden. Deshalb werden die bindenden Elektronenpaare und damit auch die Wasserstoffatome etwas "zusammengedrückt". Der Winkel ist mit 107° ebenfalls kleiner als 109,5°, aber größer als der beim Wassermolekül.
Wie kommt es zur Dipolbildung?
Ein Dipolmolekül lässt sich mit Hilfe der Elektronegativität
erklären
In einem Molekül werden die bindenden Elektronen von den einzelnen Atomen unterschiedlich stark angezogen.
Ein Maß für diese Anziehung ist die Elektronegativität (abgekürzt EN). Diese ist eine dimensionslose Größe,
die 1932 von dem Chemiker Pauling eingeführt wurde. Je größer die EN, desto stärker zieht das Atom
die bindenden Elektronen in einem Molekül zu sich. Als das Atom mit der größten EN wurde das Fluoratom
(EN = 4) bestimmt.
Betrachten wir eine Verbindung wie Fluorwasserstoff (HF), so stellen wir fest, dass das Fluor mit seiner EN von 4 die bindenden Elektronen stärker zu sich zieht als Wasserstoff, der nur eine EN von 2,2 hat.
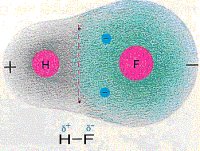
Die Folge ist eine polare Elektronenpaarbindung, bei der das Wasserstoffatom positiv und das Fluoratom negativ teilgeladen ist. Diese Teilladung gibt man in der Chemie formal mit einem δ+ für den positiven Pol und einem δ- für den negativen Pol an.
Zurück zum Wassermolekül. Auch beim Wassermolekül existieren polare Elektronenpaarbindungen. Schließlich hat Sauerstoff eine EN von 3,4 und Wasserstoff nur eine EN von 2,2. Somit zieht das Sauerstoffatom die bindenden Elektronenpaare stärker zu sich heran. Es bekommt eine negative Teilladung. Das Wasserstoffatom hingegen ist positiv teilgeladen.
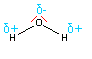
Zusätzlich zu dem Effekt der polaren Elektronenpaarbindung kommt beim Wassermolekül noch die asymmetrische Tetraederform, bedingt durch die beiden nichtbindenden Elektronenpaare, hinzu. Das hat zur Folge, dass sich die positive Teilladung des Wassermoleküls im Mittelpunkt zwischen den beiden Wasserstoffatomen zentriert, wohingegen die negative Teilladung sich am Sauerstoffatom befindet.
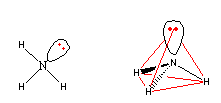
Nun zum Ammoniakmolekül: Stickstoffatome haben eine EN von 3,0 und Wasserstoffatome haben eine EN von 2,2. Das Ammoniakmolekül hat also polare Elektronenpaarbindungen, bei denen das Stickstoffatom negativ teilgeladen und die Wasserstoffatome positiv teilgeladen sind.
Wir haben jetzt erklärt, warum die Bindungen in den Molekülen von Wasser bzw. Ammoniak polar sind. Nun müssen wir noch die räumlichen Strukturen der Moleküle einbeziehen. Die Polarisierung auf der "H-Ebene" (positiv teilgeladen) und der "O- bzw. N-Ebene" (negativ teilgeladen) führt zur Bildung eines Dipolmoleküls. (Für Physikkenner: Hier lässt sich trefflich mit Vektoren operieren.)
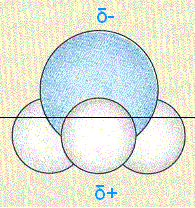
Kugelmodell des Ammoniaks
(Blaue Kugel = Stickstoff; weiße Kugeln = Wasserstoff)
Hinweis für Spezialisten
Anstelle dieses einfachen EPA-Modells gibt es das Modell der Orbital-Hybridisierung,
das im Allgemeinen in der Schule leider nur mit der Kohlenstoffchemie in Verbindung gebracht wird. Hierbei
werden die kugelsymmetrischen s- und die drei hantelförmigen p-Orbitale im Valenzzustand
so gemischt, dass sie vier äquivalente, weit ausladende Hybridorbitale (sp3) ergeben.
Diese sind in die Ecken eines Tetraeders gerichtet. Diese Hybridisierung findet auch bei Stickstoff und
Sauerstoff statt. Klicke hier.
Weitere Texte zum Thema „Ammoniak, Amine und Säure-Amide“