
Zur Toxikologie der Oxalsäure und ihrer Salze
Experimente
Versuch: Nachweis von Oxalsäure mit Kaliumpermanganat

Sauerampfer (Foto: Blume)
Früher hat wohl jedes Kind schon einmal auf der Wiese gelegen und Sauerampfer (Rumex acetosa) gekaut. Oder im Wald Sauerkleeblätter (Oxalis acetosella) genascht. Das ist aber gesundheitlich gar nicht so gut gewesen!
Noch 19. Jahrhundert wurde Oxalsäure als Säuerungsmittel für Limonaden und andere Erfrischungsgetränke genutzt, was von medizinischer Seite sogar ausdrücklich empfohlen wurde…
Im Körper ist ernährungsbedingt immer etwas Oxalsäure enthalten. Denn Oxalsäure befindet sich vor allem auch in vielen Pflanzen, die wir als Blattgemüse verzehren. Beispiele: Rhabarber, Mangold, Spinat. Aber auch Rote Bete, Schokolade und schwarzer Tee enthalten viel davon. Hinzu kommen in unserem Körper noch Seitenreaktionen des Citronensäure-Zyklus, bei denen Oxalsäure entsteht.
Aber auch beim Abbau von zu viel aufgenommener Ascorbinsäure fällt Oxalsäure an. Die entsteht durch Abspaltung der C-Atome 1 und 2 der Ascorbinsäure.
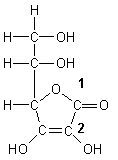
Struktur der Ascorbinsäure.
Die Ziffern bezeichnen die C-Atome, aus denen sich Oxalsäure bilden könnte
Größere Mengen von Oxalsäure sowie ihrer löslichen Salze sind giftig. Die letale Dosis für Erwachsene ist mit ca. 5 g allerdings sehr hoch. Aus diesem Grund hat die Oxalsäure samt ihrer löslichen Salze nur das Gefahrensymbol Xn erhalten.

Calciumoxalat dagegen ist so schwerlöslich, dass es als ungiftig eingestuft wird. Im Blut ist übrigens immer etwas Calciumoxalat enthalten. Mit Oxalsäure stellt man sogar Blutserum her, indem man damit die Calcium-Ionen, die zur Blutgerinnung unerlässlich sind, herausfischt.
Oxalsäure muss nicht nur oral aufgenommen werden, um ihre Giftwirkung zu entfalten. Auch durch die Haut wird die Oxalsäure gut resorbiert.
Es gibt verschiedene Mechanismen, die die Giftwirkung erklären:
Um die Giftwirkung der Oxalsäure zu verstehen, muss man die wichtige Funktion der Calcium-Ionen im Organismus kennen:
- Calcium-Ionen helfen bei Zahn- und Knochenaufbau.
- Calciumverbindungen wirken als Entzündungshemmer.
- Calcium-Ionen sind ein wichtiger Blutgerinnungsfaktor.
- Calcium-Ionen unterstützen die Muskelkontraktion.
Entsprechend vielfältig sind die Auswirkungen des Kontakts mit Oxalsäure.
| - | Schon in verdünnten Lösungen (ab w = < 5 %) wirkt die Oxalsäure auf das unter der Haut liegende Gewebe und Organe ein. Der Calcium-Entzug hat Entzündungen zur Folge. Das wird vor allem bei Arbeitern beobachtet, die aufgrund der vielfältigen Anwendungsmöglichkeiten mit der Säure umgehen müssen und die keine Schutzhandschuhe tragen. |
| - | Durch Komplexbildung wird die Darmresorption von Ca-Ionen gestört. Das ist vor allem für Kinder während des Wachstums und der Zahnbildung wichtig. Auch Kühe, die im Winter die Blätter von stark Oxalsäure-haltigen Rübenblättern fressen müssen, bekommen vom Landwirt zum Ca-Ausgleich Kalkzusätze ins Futter. |
| - | Der Calcium-Entzug im Blut hat akute Herz- und Kreislaufschäden zur Folge. |
| - | Zuviel Oxalsäure wirkt sich störend auf die Blutgerinnung aus. |
| - | Oxalsäure hemmt wahrscheinlich ein Enzym, die Succinatdehydrogenase. Dies ist ein Schlüsselenzym des Citronensäure-Zyklus. |
| - | Wenn man zuviel Oxalsäure aufgenommen hat, wird Oxalsäure samt ihren Salzen normalerweise ausgeschieden (Oxalurie). Das geschieht meistens in der Form von schwerlöslichem Calciumoxalat, das als feinstes Pulver einfach ausgespült wird. Funktioniert das nicht richtig, so kommt es in den Nieren zur Bildung von Calciumoxalat-Steinen. Diese sind ziemlich grob strukturiert und bereiten leicht Schmerzen. Außerdem kann es zur Nierenverstopfung (Niereninfarkt) mit Urämie als Folge kommen. |
Ob ein Nierenstein aus Oxalat besteht, kann man leicht mit einem Versuch ergründen.
Was tun bei akuten Oxalsäure-Vergiftungen?
Es wird empfohlen, Magnesiumsalzlösungen zu trinken. Wenn man die nicht hat, sollte man Magnesiumtabletten zu sich
nehmen, am besten schon gelöst, damit sie schnell wirken. Magnesium bildet ebenfalls schwerlösliche Oxalate. Jedoch ist
sein Löslichkeitsprodukt („Ionenprodukt“) um den Faktor 1000 größer als das von Calciumoxalat.
L(Ca-Oxalat-Dihydrat) = 2,32 • 10-9
L(Mg-Oxalat-Dihydrat) = 4,83 • 10-6
Magnesiumoxalat ist also deutlich besser löslich als Calciumoxalat.
Das Massenwirkungsgesetz lehrt uns: Nimmt man große Mengen an löslichen Magnesium-Präparaten aus der Apotheke zu sich, besteht eine Chance, dass genügend Oxalat-Ionen in Lösung bleiben. Zum Beispiel können Magnesium-Ionen Calcium-Ionen aus festem Calciumoxalat verdrängen, wodurch das Oxalatgitter zerfällt. Auf diese Weise wird ein nicht unbeträchtlicher Teil des Oxalats über die Niere ausgeschieden. Ein Abfluss des lebenswichtigen Calciums wird dadurch eingeschränkt.
Weitere Texte zum Thema "Oxalsäure"