| Klick mich an! |
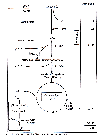 |
| Abb. 32: Kurzer Überblick über den Abbau der Glucose |
| Klick mich an! |
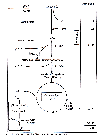 |
| Abb. 32: Kurzer Überblick über den Abbau der Glucose |
4.2.2 Oxidativer Abbau der Glucose bis zu Acetyl-CoA
Der oxidative Abbau der Glucose zu Kohlendioxid und Wasser
umfasst die folgenden Reaktionsgruppen (-> Abb. 32):
A. Glykolyse
Die Glykolyse ist der oxidative, aber anaerobe Abbau von Glucose zu Brenztraubensäure und reduzierenden Äquivalenten [H]:
Folgende Punkte sind zum Verständnis der chemischen Abläufe wichtig:
| 1. | Jeder Reaktionsschritt wird durch mindestens ein Enzym katalysiert. |
| 2. | Die Oxidation erfolgt nicht durch Reaktion
mit Sauerstoff, sondern durch schrittweises Abspalten von
Reduktionsäquivalenten [H]. Diese werden vom Substrat auf NAD+
(Nicotinsäureamiddinucleotid) übertragen und liegen
anschließend gebunden als NADH vor:
Substrat-H2 + NAD+ ———> Substrat (ox) + NADH + H+ Primäres Oxidationsmittel der Biochemie ist also NAD+ und nicht Sauerstoff. |
| 3. | Die Oxidationsenergie wird durch Bildung von ATP aus ADP und Phosphat abgefangen. |
| 4. | Sauerstoffatome, die in die Substrate eingebaut werden, stammen aus dem Wasser, das an Doppelbindungen addiert wird. Kohlendioxid entsteht bei Decarboxylierungen. |
Der Ablauf der Glykolyse kann kurz wie folgt dargestellt werden (-> Abb. 33):
Glucose wird mit dem Blut ins Gewebe transportiert. Unter
Mitwirkung des blutzuckersenkenden Hormons Insulin wird sie unter
gleichzeitiger Phosphorylierung durch ATP in die Zelle eingeschleust.
Es folgt Isomerisierung der Glucose zu Fructose. Mit
einem weiteren ATP bildet sich Fructose-1,6-diphosphat. Bis hierhin
ist ATP ausschließlich investiert worden.
| Klick mich an! |
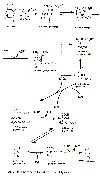 |
| Abb. 33: Chemische Reaktionen der Glykolyse |
Dieser Zuckerester wird gespalten in zwei C3-Segmente, die miteinander im chemischen Gleichgewicht stehen und von denen sich die Komponente Glycerinaldehyd-3-phosphat oxidativ in Glycerinsäure-3-phosphat umwandelt.
Die Oxidation von Glycerinaldehyd erfolgt unter gleichzeitiger Bildung eines Säureanhydrids zwischen der gebildeten Glycerinsäure und Phosphorsäure. Dieses wird unter ATP-Bildung gespalten, es bildet sich Glycerinsäure-3-phosphat. Es erfolgt Umlagerung zu Glycerinsäure-2-phosphat und anschließend Wasserabspaltung (Dehydratisierung) zu Phosphorenolbrenztraubensäure. Diese stellt aufgrund des sauren Charakters von Enolen ebenfalls ein energiereiches Säureanhydrid mit Phosphorsäure dar, das wieder unter ATP-Bildung gespalten wird. Es resultiert das Endprodukt der Glykolyse, die Brenztraubensäure.
Die Bilanz der Glykolyse ist (P bezeichnet Phosphat oder Phosphorsäure):
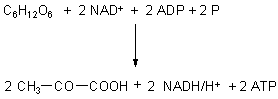
B. Rückgewinnung von NAD+. Gärung und Atmung
Als Problem macht sich bei der Glykolyse rasch das Anhäufen von NADH und somit der Mangel am Oxidationsmittel NAD+ bemerkbar, da dessen Konzentration in der Zelle gering ist. Damit sollte die Glykolyse nach kurzem Anlaufen zum Stillstand kommen. Die Zellen müssen folglich ständig NAD+ regenerieren. Dies ist grundsätzlich auf zwei Wegen möglich, deren Richtung vom Redoxmilieu des Reaktionsortes abhängt:
a) Bei Sauerstoffmangel (anaerobes Milieu, z. B. im eutrophierten See, im Dünndarm oder im schlecht durchbluteten Muskel) wird NAD+ aus NADH durch Reduktion von End- oder Zwischenprodukten der Glykolyse zurückgebildet (Gärung). Diese vertreten den Sauerstoff als Oxidationsmittel, wobei sie selbst reduziert werden. Dabei ist der Energiegewinn nur minimal. Einige Beispiele hierfür sind:
Acetaldehyd + NADH + H+ ———>
Ethanol + NAD+
Pyruvat + NADH + H+ ———>
Milchsäure + NAD+
Glycerinaldehyd + NADH + H+ ———>
Glycerin + NAD+
Die Produkte werden an das äußere Milieu abgegeben, wobei sie als nunmehr reduzierende Stoffe die Umgebung noch anaerober einstellen. So kann ein See schließlich "umkippen".
Bakterien können an dieser Stelle auch Sulfat-Ionen reduzieren, wobei sie den für anaerobe Umgebungen typischen Schwefelwasserstoff bilden:
Andere Wege führen vom Nitrat zum giftigen Nitrit, was auch im Darm von Kleinkindern abläuft:
b) Bei Sauerstoffanwesenheit (aerobes Milieu) wird NAD+ durch Oxidation von NADH mit Hilfe von freiem Sauerstoff zurückgebildet (Atmung):
Dieser Weg (die Atmungskette; -> 4.2.4) ist energetisch wesentlich effektiver als die Gärung.
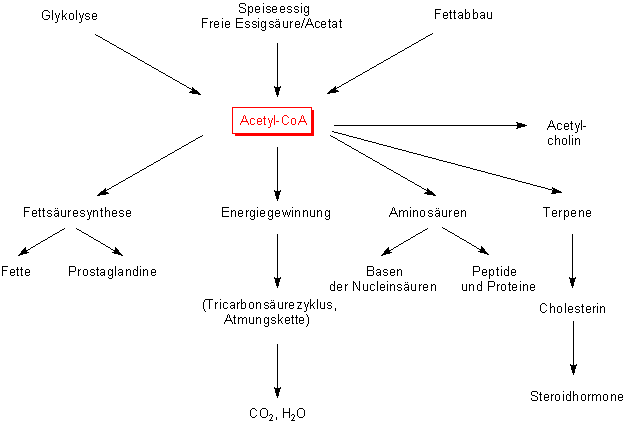
Abb. 34: Stoffwechselschaltstelle Acetyl-CoA
C. Aktivierte Essigsäure
Aktivierte Essigsäure (im Biochemikerjargon Acetyl-CoA genannt) stellt eine wichtige Schaltstelle im Stoffwechsel dar (-> Abb. 34). Sie entsteht auch beim Abbau der Fettsäuren, bei der Oxidation von Glycerin und Ethylalkohol sowie beim Abbau von Aminosäuren. Andererseits ist die aktivierte Essigsäure wiederum Grundbaustein für Fettsäuren. Hier liegt der Zusammenhang zwischen zuviel Nahrung, Alkohol und dem Fettansatz begründet. (Das Glycerin für die Fettsynthese wird ebenfalls aus der Glykolyse abgezweigt.) Aktivierte Essigsäure ist auch Grundbaustein für die Synthese von Cholesterin, Nebennierenrinden- und Sexualhormonen sowie Prostaglandinen. In den Pflanzen bilden sich aus aktivierter Essigsäure Terpene, Carotinoide, Kautschuk und Lignin.
Aktivierte Essigsäure ist nicht nur Synthesebaustein, sondern wird weiterhin zur Energieumwandlung oxidativ abgebaut. Auch dabei werden Reduktionsäquivalente [H] und ATP gebildet, und zwar wesentlich mehr, als bislang im Verlauf der Glykolyse entstanden sind. Dies geschieht mit Hilfe des Citronensäurezyklus. Dieser wird auch Tricarbonsäurezyklus genannt.
4.2.3 Citronensäurezyklus (Tricarbonsäurezyklus)
Die Oxidation von Essigsäure (bzw. Acetyl-CoA) wird durch die folgende Gleichung beschrieben:
Auch diese Oxidation läuft schrittweise ab, um die Energieausbeute zu optimieren. Die Reaktionssequenz ist einer der schönsten biochemischen Katalyse-Kreisläufe, der Citronensäurezyklus (-> Abb. 32 und 35).
Der Kreislauf dient dazu, Essigsäure zu CO2 und Reduktionsäquivalenten [H] abzubauen und das Startmolekül Oxalessigsäure zurückzugewinnen.
Die Reaktionen können kurz wie folgt beschrieben werden (-> Abb. 35):
Aktivierte Essigsäure wird auf Oxalessigsäure übertragen, wobei sich Citronensäure bildet. In den nächsten zwei Schritten wird Citronensäure zu Isocitronensäure umgelagert. Diese wird mit NAD+ oxidiert, wobei eine instabile Verbindung gebildet wird, die unter Bildung von a-Ketoglutarsäure CO2 abspaltet (decarboxyliert).
Die Ketoglutarsäure wird erneut unter Mitwirkung von NAD+ oxidativ decarboxyliert, wobei Bernsteinsäure entsteht. (Hierbei wird die Oxidationsenergie erstmals direkt als ATP abgefangen.) Aus Bernsteinsäure werden zwei H-Atome abgespalten. Diese Dehydrierung führt zu Fumarsäure. (Das Oxidationsmittel ist diesmal FAD.)
An Fumarsäure wird ein Molekül Wasser addiert: Äpfelsäure entsteht. (Dies ist ein Beispiel für nichtoxidative Einführung eines Sauerstoffatoms. Der Sauerstoff hat seine Oxidationszahl nicht geändert.) Äpfelsäure wird mit NAD+ zu Oxalessigsäure oxidiert. Damit ist der Zyklus geschlossen.
| Klick mich an! |
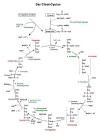 |
| Abb. 35: Citronensäurezyklus |
Zwischenbilanz des Glucoseabbaus:
Der Abbau der Glucose ist bis jetzt folgendermaßen verlaufen (ab Acetyl-CoA muss alles doppelt gezählt werden):
Die Reduktionsäquivalente [H] liegen als NADH + H+ (bzw. FADH2) vor.
| Klick mich an! |
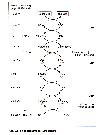 |
| Abb. 36: Reaktionsschema der Atmungskette |
4.2.4 Die Endoxidation. Atmungskette
Abschließend wird der als [H] vorliegende Wasserstoff mit Atmungssauerstoff zu Wasser oxidiert. Dabei wird der größte Teil des Energiegehaltes unserer Lebensmittel ausgeschöpft. (Der evolutionäre Grund wird gewesen sein, dass hier ein Mittel gefunden wurde, den zellschädigenden Sauerstoff abzubauen.) Das hierfür zuständige Zellorgan ist das Mitochondrium mit der Atmungskette, deren Reaktionsschema die Abb. 36 zeigt.
Zur Oxidation von Wasserstoff sind drei Wege denkbar und realisiert:
1. Knallgasreaktion
Der Vergleich mit der Verbrennung von Wasserstoff, bei der nur
wertlose Licht- und Wärmeenergie entstehen, liegt nahe. Die
Reaktion bei dieser Knallgasreaktion läuft lawinenartig und deshalb
ungesteuert ab (-> Abb. 37a). Denken Sie an die Knallgasexplosionen
von Lakehurst, Cape Kennedy oder Tschernobyl:
2. Atmungskette
Dagegen erfolgt die Oxidation von NADH mit Hilfe einer komplizierten
enzymatischen Reaktionssequenz, der Atmungskette (-> 37b):
(Der Wert der freigesetzten Energie ist geringer, weil NADH bereits eine oxidierte Form von Wasserstoff ist.)
Die Ausbeute an nutzbarer Energie wird gesteigert, indem der Redoxprozess zwischen NADH/H+ und O2 in einer Serie von Reaktionsschritten zerlegt wird, wobei die Wege für Wasserstoff und Elektronen getrennt verlaufen.
Von den maximal möglichen 218 kJoule werden etwa 130 kJoule als chemische Energie (Freie Energie) in Form von 3 Mol ATP abgefangen. Die restliche Energie wird als Körperwärme freigesetzt. Das bedeutet einen Wirkungsgrad von über 60 %.
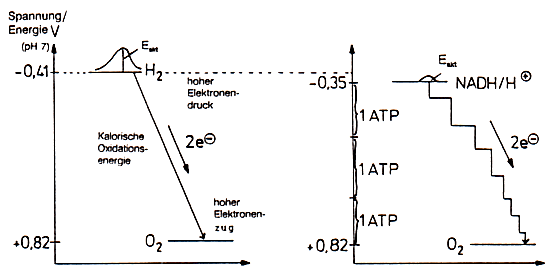
Abb. 37a, 37b: Energieschema der Knallgasreaktion und der Atmungskette im Vergleich
3. Brennstoffzelle
Ein technisch verwirklichter Kompromiss zwischen beiden Reaktionsabläufen
ist die Knallgaszelle, bei der die Oxidation von H2 und die
Reduktion von O2 getrennt an zwei katalytisch wirkenden
Edelmetalloberflächen ablaufen (-> Abb. 38). Zwischen beiden
Elektroden baut sich die Spannung 1,23 V auf, bei Kurzschluss oder
Einschalten eines Verbrauchers fließt Strom. In diesen sog.
Brennstoffzellen kann man bei vorsichtiger Führung Wirkungsgrade
von fast 100 % erreichen. (Als Reduktionsmittel verwendet man
anstelle von Wasserstoff auch Glucose, Milchsäure oder sogar
Kohlenwasserstoffe.)
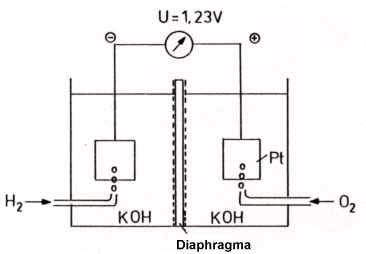
Abb. 38: Knallgaszelle
Die Reaktionen der Atmungskette
Zunächst wird NADH durch FMN oxidiert, FMNH2 durch Ubichinon (-> Abb. 36). Ab dieser Stelle verlaufen Elektronentransport und Protonentransport getrennt:
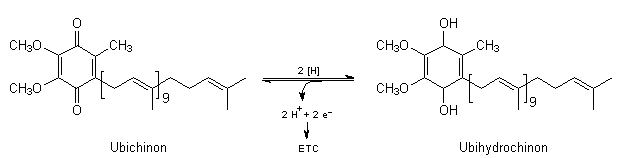
Abb. 39: Feinmechanismus der Redoxreaktionen von Ubichinon
Beide (sowohl H+ als auch e¯) werden letztlich auf Sauerstoff übertragen. Das Transportsystem für die Elektronen besteht aus einer ganzen Reihe (ETC) von eisenhaltigen Proteinen, den Cytochromen, deren Eisen-Ionen beim Elektronentransport nur einem Ladungswechsel unterliegen:
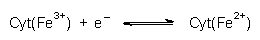
Dabei erfolgt eine Abschwächung des stark negativen Potentials der Elektronen durch stufenweise Anhebung über Fe3+/Fe2+-Redoxgleichgewichte mit dem Ziel, die dabei freiwerdende potentielle Energie als ATP abzufangen.
An letzter Stelle steht die Cytochromoxidase mit dem Cyt a/a3, einem Fe- und Cu- haltigen Enzym. Hier erfolgt die Reduktion des finalen Elektronenakzeptors, des Sauerstoffs:
Das negative Sauerstoff-Ion reagiert mit den Protonen zu Wasser, einem der Endprodukte des Glucoseabbaus:
Endbilanz der Glucoseoxidation
Pro Mol Glucose wurden je 6 Mol Wasser und CO2 sowie 38 Mol ATP gewonnen:
4.2.5 Zusammenhänge des Citronensäurezyklus mit
anderen Stoffwechselwegen
Mit dem Citronensäurezyklus sind andere Stoffwechselwege verwoben. Dies gilt besonders für Aminosäuresynthese, -umbau und -abbau sowie für den Stoffwechsel der Nucleinsäurebasen als auch für den Harnstoffzyklus. Als Ausscheidungsprodukte entstehen vor allem Ammonium-Ionen und Harnstoff. Letzterer entsteht im Harnstoffzyklus, der über Asparaginsäure/Oxalessigsäure mit dem Citronensäurezyklus verbunden ist, nach folgender formaler Reaktion:
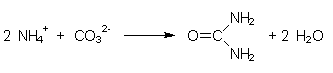
4.2.6 Regelung einiger Reaktionen
Die Reaktionen des Abbaus von Glucose und die Endoxidation
werden vor allem energetisch und stofflich gesteuert. Beispiele sind
unter vielen anderen:
Die Atmungskette wird aktiviert durch:
4.2.7 Einige Beispiele für Vergiftungsmechanismen
| - | Nitrophenol als Schilddrüsenhormon-Analoges entkoppelt die Atmungskette; es wird nur Wärme produziert. |
| - | Arsenat konkurriert in der Atmungskette mit
Phosphat um den ATP-Syntheseplatz, ohne aber eine Bindung
einzugehen; Wärmefreisetzung ist die Folge.
Arsenat hemmt auch die oxidative Decarboxylierung von a-Ketoglutarsäure. |
| - | CO, H2S, CN¯ komplexieren irreversibel das Eisen-Ion in der Cytochromoxidase, so dass ein Wertigkeitswechsel nicht mehr möglich ist. |
| - | Fluorid-Ionen hemmen den Citronensäurezyklus. Dies betrifft auch Bakterien (Kariesprophylaxe). |