Zweitsubstitution von Phenol am Beispiel der Bromierung und Nitrierung
Experimente:
Versuch: Bromierung von Phenol
Versuch: Nitrierung von Phenol
Phenol ist ein Derivat des Benzols. Durch weitere Substitutionsreaktionen, wie z. B. die
Bromierung (-> Versuch) oder die Nitrierung (-> Versuch),
können daraus neue Verbindungen gewonnen werden. Dabei hat die OH-Gruppe als Erstsubstituent
Einfluss auf die Zweitsubstitution; einmal auf die Reaktionsgeschwindigkeit und zweitens auf
den Ort der Zweitsubstitution.
Reaktionsgeschwindigkeit
Obwohl die OH-Gruppe des Phenols eigentlich wegen der größeren Elektronegativität nach dem
negativen Induktions-Effekt (-I-Effekt) Elektronen aus dem Ring ziehen müsste,
tut sie genau das Gegenteil. Denn die Elektronen der OH-Gruppe des Phenols treten in Wechselwirkung
mit dem aromatischen Ring, wobei Elektronen in den Ring hineingeschoben und der Ring dadurch
aktiviert wird. Das heißt, dass die OH-Gruppe einen positiven Mesomerie-Effekt (+M-Effekt)
auf den Ring ausübt. Der -I-Effekt ist schwächer als der +M-Effekt. (Wie sich ein Erstsubstituent mit
(-I, -M)-Effekt auf die Zweitsubstitution auswirkt, erklären wir vergleichend am Beispiel des
Nitrobenzols.)
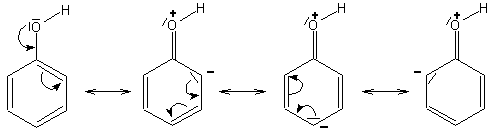
Es können für die Elektronenverteilung im Phenol folgende mesomere Grenzstrukturen formuliert werden:

Wegen der negativen Ladung im Phenolring läuft die elektrophile ("elektronenliebende") Substitution mit Brom schneller ab als beim Benzol. Diese Ladungsverteilung ist Ursache für die Polarisation des Brommoleküls, das sich nun in Br- und Br+ aufspalten kann.
Dirigierende Wirkung des Erstsubstituenten
Die Hydroxyl-Gruppe als Erstsubstituent dirigiert den Zweitsubstituenten vorzugsweise in ortho-
und para-Stellung, denn die mesomeren Grenzformeln des Phenols zeigen an diesen Stellen eine negative Ladung.
Hier erfolgt der Angriff von Br+. Es entsteht zunächst ein s-Komplex
als Zwischenstufe, der ebenfalls mesomeriestabilisiert ist.
| Grenzstrukturen der s-Komplexe bei der Bromierung von Phenol |
| Angriff in ortho-Stellung |
|
| Angriff in para-Stellung |
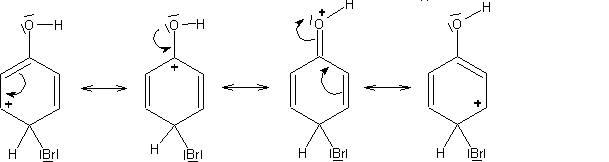 |
Nun wird unter Einwirkung des Br- ein H+ abgespalten.
Das so entstandene Bromphenol kann bis zum 2,4,6-Tribromphenol substituiert werden.
Die Reaktionsgleichung der vollständigen Substitution lautet:
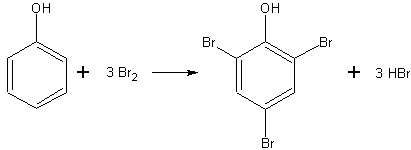
Das 2,4,6-Tribromphenol ist schwer löslich und fällt aus (Versuch).
Die Nitrierung des Phenols (-> Versuch) verläuft analog zur Bromierung. Hierbei erfolgt der Erstangriff allerdings durch ein NO2+-Ion, das mit Schwefelsäure aus Salpetersäure gebildet wird. (Die Säuremischung heißt Nitriersäure.)
HNO3 + H+ ———> H2O + NO2+
Die Gruppe der Nitrophenole beinhaltet wichtige Substanzen, denen wir eine eigene Webseite widmen.
Weitere Texte zum Thema „Phenole“