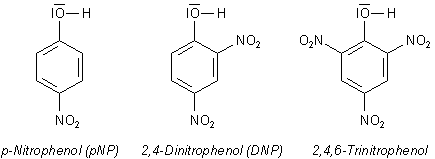
Nitrophenole - Die besondere Phenolgruppe
Die verschiedenen Nitrophenole bilden eine Stoffgruppe von großer chemischer
und physiologischer Bedeutung. Es handelt sich um kristalline Substanzen.
Man stellt die wichtigsten Vertreter her, indem man Phenol mit verdünnter Salpetersäure
behandelt. Die Hydroxygruppe drängt die Zweitsubstitution in die
ortho- und para-Stellung.
Die Strukturformeln der wichtigsten Nitrophenole sind hier abgebildet.

Nitrophenole reagieren deutlich sauer
Gemeinsam ist allen, dass sie (verglichen mit dem schwach sauren Phenol) bei niedrigeren pH-Werten
dissoziieren. Das liegt daran, dass die Nitrogruppen elektronenziehend
wirken und somit die Bindung zwischen dem phenolischen O und H lockern. Je mehr Nitrogruppen im
Molekül sind, desto leichter dissoziiert das Phenol. Das zeigt sich an den pK-Werten.
| Phenol | 9,89 |
| p-Nitrophenol | 7,15 |
| 2,4-Dinitrophenol | 4,02 |
| 2,4,6-Trinitrophenol | 1,02 |
Trinitrophenol ist sogar so sauer, dass man es als Säure bezeichnet. Genau heißt die Substanz Prikrinsäure. Darin steckt auch noch das griechische Wort pikros, bitter. Denn die Säure und ihre Salze schmecken ausgesprochen bitter.

Feuchte Pikrinsäure (Foto: Daggi)
Da die Lösungen der Anionen von pNP und von DNP gelb gefärbt sind, die Phenole selbst aber farblos
sind, verwendet man diese beiden Nitrophenole im pH-Bereich ihrer pK-Werte als
Säure/Base-Indikatoren. So schlägt DNP zwischen
den pH-Werten 2,8 und 4,7 um. Allerdings ist ihr Farbumschlag nicht so gut zu erkennen, da die
gelbe Farbe für uns nicht so deutlich ins Auge springt.
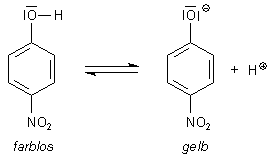
Der Grund für die Farbänderung liegt darin, dass die Mesomerie des Elektronensystems im Falle des undissoziierten Phenols eine Ladungstrennung zur Voraussetzung hat. Im dissoziierten Molekül wird - energetisch wesentlich günstiger - nur ein freies Elektron durch den Ring geschoben.
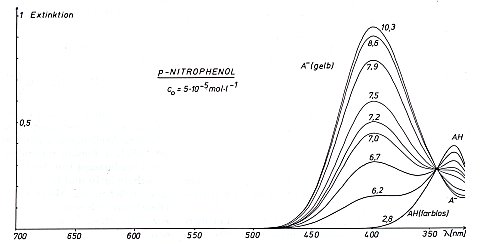
Spektren von pNP und pNP-Anion
Das Bild ist das Ergebnis der spektralfotometrischen Titration von pNP. Die Zahlen an den Kurven sind
die pH-Werte der entsprechenden Lösungen. Zieht man bei 400 nm eine senkrechte Linie, so halbiert
das Spektrum bei etwa pH 7,1 die Strecke zwischen den Spektren, die die Zustände der Lösung bei
pH 10,3 und 2,8 beschreiben. An diesem Punkt sind die Konzentrationen von Phenol und Phenolat
gleich - hier liegt definitionsgemäß der pK-Wert.
Beim Trinitrophenol sind die Elektronen bereits so leicht anregbar, dass auch die
undissoziierte Pikrinsäure tiefgelb gefärbt ist.
Darauf beruht auch die bekannte Proteinnachweisreaktion mit Salpetersäure. Bei
dieser Xanthoproteinreaktion wird
vor allem die Aminosäure Tyrosin nitriert und bildet eine gelbe Farbe; xanthos
(griechisch), gelb.
Nitrophenole sind explosiv
Die Salze der Pikrinsäure heißen Pikrate. Sie sind seit langem als Sprengstoffe
bekannt. Sie explodieren ohne Zufuhr von Sauerstoff, da sie den Sauerstoff
förmlich in sich tragen. Bei der Zersetzung werden auf einem Schlag viele heiße
Gase frei.
C6H3N3O7 ———> CO, CO2, N2, NOx, H2O
Da die Säure und ihre Salze im trockenen Zustand leicht explodieren können, muss man sie deshalb mit Wasser versetzen (siehe Foto oben). Diese Maßnahme bezeichnet man in der Sprengstofftechnik treffend als "Phlegmatisieren". Das ist übrigens bereits auch schon beim Hantieren mit Dinitrophenol zu beachten.
In letzter Zeit ist es wegen eines Fundes an 2-Methyl-4,6-Dinitrophenol (DNOC) zu einem Einsatz von Feuerwehr und Sprengstoffexperten gekommen. Klicke hier.
Nitrophenole sind von großer technischer Wichtigkeit
Man benötigt sie zum Beispiel bei der Farbstoffherstellung. So können sie zunächst zum Anilin
reduziert und dann diazotiert werden. Daraus stellt man dann Azofarbstoffe
her.
Nitrophenole in der biochemischen Forschung
Vor allem das pNP hat eine wichtige Rolle gespielt bei der Untersuchung enzymatischer Reaktionen.
Das betraf vor allem die Hydrolasen. Hierzu gehören Esterasen oder Peptidasen, aber auch die Phosphatasen.
Man kann p-Nitrophenol leicht verestern, zum Beispiel mit Essigsäure oder Phosphorsäure. Das so erhaltene
p-Nitrophenolacetat (pNPA) oder -phosphat (pNPP) hat man den Enzymen als Modellsubstrate angeboten. Da sich
die Spektren von pNP und pNPA deutlich unterscheiden, konnte man die Enzyme reaktionskinetisch analysieren.
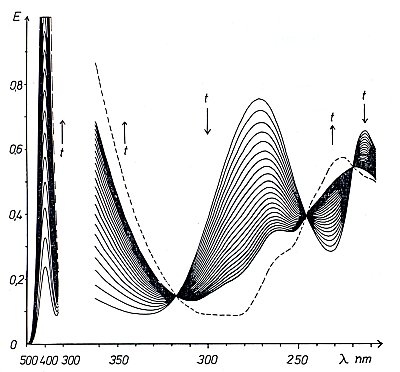
Spektren von pNP und pNPA
Es handelt sich hier um das Spektrum einer pNPA-Hydrolyse. Dabei wurden die Spektren in gleichem
Zeitabstand immer wieder aufgenommen. Das Symbol t steht für den Parameter Zeit. Die gestrichelte
Linie ist die des Zustands nach Reaktionsablauf, zeigt also das Spektrum des pNP beim entsprechenden
pH-Wert. Da eine starke Absorption im Bereich der Farbe "Blau" zu erkennen ist, muss die Lösung
gelb sein. Die Lösung war somit alkalisch.
Nitrophenole sind toxisch
Die Aufnahme von Nitrophenolen verursacht starkes Schwitzen und erhöhte Körpertemperatur. Der Grund ist,
dass sie als Entkoppler der oxidativen Phosphorylierung wirken.
Es geht hier um die Atmungskette in den Mitochondrien. Die chemische Energie des NADH (usw.) wird
hier schrittweise mit Hilfe eines Systems zum Transport von Elektronen auf Sauerstoff in chemische
Energie in Form von ATP umgesetzt. Geschwindigkeit und Umfang der Elektronenübertragung sind eng mit
dem Bedarf an ATP verknüpft. Wenn der Verbrauch von ATP gering ist, ist die Geschwindigkeit der
Elektronenübertragung daher ebenfalls gering und umgekehrt. Bei einer normalen Kopplung werden mit
NADH als Elektronendonator ungefähr drei Moleküle ATP pro Atom Sauerstoff produziert. Dieses Verhältnis
wird als P/O-Verhältnis bezeichnet. In Gegenwart von Entkopplern wird kein ATP gebildet, sondern die
chemische Energie wird nur als nutzlose Wärme abgegeben.
Das ist eigentlich nichts Ungewöhnliches. Normalerweise steuert diesen Vorgang die Schilddrüse mit
ihren Hormonen. Wenn allerdings zuviel Hormon produziert wird, gibt es das Basedowsche Krankheitsbild.
Auch das ist gekennzeichnet durch erhöhte Körpertemperatur und durch Schwitzen.
Der Grund für die gleiche Wirksamkeit ist die strukturelle Ähnlichkeit der Moleküle der Nitrophenole mit denen der Schilddrüsenhormone.
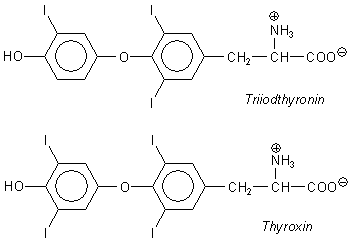
Die Halogenatome an den Ringen wirken ähnlich elektronenziehend (-I-Effekt) wie die Nitrogruppen. Die Folge ist, dass auch die Schilddrüsenhormone zu den besonders sauren Phenolen gezählt werden müssen. Offenbar besetzen Nitrophenole und die Schilddrüsenhormone gleiche Rezeptoren und üben deshalb auch gleiche physiologische Wirkungen aus.
In diesem Zusammenhang ist es fast erheiternd, wenn man erfährt, dass man früher 2,4-DNP als Schlankheitsmittel verschrieben hat. Der Grund: Die Menschen konnten essen, so viel sie wollten, aber sie nahmen nicht zu, da das für die Fettsynthese nötige ATP fehlte. Erst nach einigen Todesfällen hat man davon abgesehen...
Nitrophenole sind Allergieauslöser
Viele Nitrophenole sind Allergene. Das äußert sich im Auftreten von Nesselfieber (usw.) bei
Biochemikern, die viel mit pNPA gearbeitet haben. Man fasst diese allergenen Aromaten zur Gruppe
der "Parastoffe" zusammen.
Berüchtigt ist in diesem Zusammenhang auch das von Pilzen hergestellte gelbfarbene Antibiotikum
Chloramphenicol.
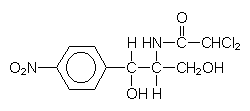
Chloramphenicol
Zu dieser Gruppe von Allergenen gehören auch Produkte wie das Hustenmittel Bisolvon mit dem Inhaltsstoff Bromhexin. Das ist ein Alkaloid aus der Pflanze Adhatoda vasica.
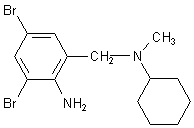
Bromhexin
Wer Allergiker ist, wird diese Stoffe meiden und genau beachten, was er verschrieben bekommt. So ist Chloramphenicol in vielen Augensalben versteckt oder auch in Zubereitungen enthalten, mit denen zum Beispiel Nierenbeckenentzündungen bekämpft werden. Chloramphenicol wird jedoch auch in der Tiermedizin trotz Verbots angewandt und gelangt dann über die Nahrung in die Menschen. Ostasiatische Shrimps sollen damit so voll gepumpt sein, dass sie sich gelb verfärben. Aber auch Bisolvon ist in der Tiermedizin gebräuchlich. Die Tierzüchter müssen zwar vor dem Schlachten nach der Behandlung mit Bisolvon eine bestimmte Zeit abwarten, damit das Tier den Stoff ausscheidet. Ich habe da als studierter Biochemiker (und deshalb als Parastoff-Allergiker) so meine Zweifel an deren Ehrlichkeit und esse deswegen wenig Fleisch.
Charge-Transfer-Komplexe mit Nitrophenolen
Nitrophenole (und hier vor allem die Pikrinsäure) bilden leicht Charge-Transfer-Komplexe
(CT-Komplexe). Die Pikrinsäure ist Elektronenakzeptor. Als Donator dienen kondensierte Aromaten
wie Naphthalin und Anthracen. Die CT-Komplexe bilden im Allgemeinen prächtig gefärbte Lösungen. (Lösemittel ist
Tetrachlorkohlenstoff.)
Weitere Texte zum Thema „Phenole“