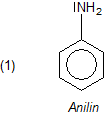
Anilin
Experimente:
Versuch: Unterscheidung von Dieselkraftstoff und Heizöl (Furfurol-Reaktion)
Versuch: Qualitativer Nachweis von Zuckern mit der DC
Versuch: Qualitativer Nachweis von Kohlenhydraten mit Anilin
Versuch: Färben mit Anilinschwarz
Anilin ist Aminobenzol. Es ist das einfachste aromatische Amin (Phenylamin).

Die Bezeichnung „Aniline“ steht für alle Amino-Aromaten (Arylamine), so wie die Bezeichnung „Phenole“ für alle Hydroxylaromaten steht.
Herstellung von Anilin
Anilin wurde im Jahre 1826 erstmals von einem Apotheker namens Otto Unverdorben hergestellt. Der erhitzte
Indigo zusammen mit Kalksteinpulver. Acht Jahre später entdeckte
F. F. Runge Anilin auch im Steinkohlenteer und bemerkte als Erster
dessen farbgebenden Eigenschaften, indem er es mit Chromat zu einem blaugrünen Farbstoff oxidierte. Aber erst die
Wiederentdeckung der Indigozersetzung führte viele Jahre später zur heutigen Benennung des Anilins und damit zur endgültigen Fixierung
in der Wissenschaft. Sein Name beruht auf dem arabischen Wort an-nil (bedeutet „blau“,
aber auch „Indigo“). Der in lateinischen Ländern gebräuchliche Name für Indigo ist ebenfalls anil.
Anilin wird technisch vor allem durch Reduktion von Nitrobenzol hergestellt. Ein Reduktionsmittel ist Wasserstoff „in statu nascendi“, den man durch Reaktion zwischen Salzsäure und Eisen bereitstellt.
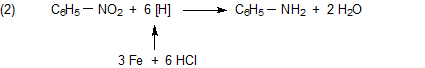
Ein modernes Verfahren (Halcon-Prozess) beruht auf der katalysierten Ammonolyse von Phenol.
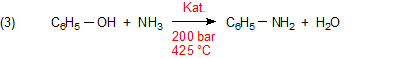
Katalysatoren sind unter anderem mit Cer dotierte Silicate und Metalloxide.
Analog verläuft ein Verfahren, dass statt von Phenolat von Chlorbenzol ausgeht.
Eigenschaften
Anilin ist eine Flüssigkeit, die wie fast alle Amine unangenehm riecht. Dazu ist es ein Blutgift, das auch über die Haut
aufgenommen wird. Es steht auch in Verdacht, krebserregend zu sein.
Bereits nach kurzem Stehen an der Luft setzt Autoxidation ein; es kommt zur Polymerisation unter Bildung brauner Produkte.
Deshalb muss Anilin vor Gebrauch immer frisch destilliert werden (Siedepunkt 184 °C).
Anilin ist eine schwache Base
Aliphatische Aminoverbindungen sind chemisch betrachtet zwar schwache
Brönsted-Basen, wirken aber mit pKa-Werten um 9-10 recht stark basisch.
Dagegen reagiert Anilin nur in deutlich saurem Milieu als Base.
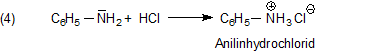
Der pKa-Wert beträgt deshalb auch nur 4,63. Anders ausgedrückt: Es bedarf eines hohen Protonendrucks, um
Anilin zu protonieren. Damit hängt auch zusammen, dass Anilin kaum Wasserstoffbrücken bildet und deshalb in Wasser schlecht
löslich ist. Letztlich ist Anilinhydrochlorid (bzw. das Anilinium-Kation) in etwa so sauer wie Essigsäure,
deren pKa-Wert bei 4,76 liegt.
Das alles liegt daran, dass das nichtbindende („freie“) Elektronenpaar des Stickstoffs anderweitig „beschäftigt“ ist und nicht ohne weiteres zur Bindung von Protonen oder zur Ausbildung von Wasserstoffbrücken zur Verfügung steht. Den Grund beschreiben wir im nächsten Abschnitt.
Die Mesomerie des Anilinmoleküls
Die Aminogruppe steht mit dem aromatischen Ring in enger Wechselwirkung. Deren N-Atom stellt seine nichtbindenden Elektronen
aber nicht (wie etwa bei den N-Heterozyklen) vollständig dem Ring zur Verfügung, sondern richtet
mehr oder weniger eine Doppelbindung zwischen sich und dem C-Atom auf. Es handelt sich um einen Substituenten 1. Ordnung,
also um einen, der Elektronen in das bereits existierende aromatische System drückt. Mit diesem positiv induktiven Effekt
(+I-Effekt) fördert die Aminogruppe die Mesomerie des gesamten Ringsystems. Man spricht von einem
+M-Effekt.
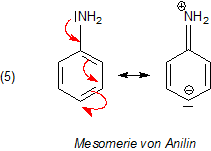
Wir sehen, dass die Aminogruppe im zeitlichen Mittel eher positiv geladen ist und Protonen am Andocken behindert. Das ist der Grund für die geringe Basizität des Anilins. Man kann aus den mesomeren Grenzstrukturen weiter ablesen, dass Anilin im alkalischen Milieu sogar als Säure wirkt, weil die Aminogruppe eher Protonen abgeben als aufnehmen kann.
Einige Reaktionen des Anilins
Vor allem ist Anilin als Edukt der Farbenchemie (und damit auch der Medikamenten-Industrie) bekannt. Schon sein Nachweis durch
Runge gehört hierhin: Wenn man Anilin mit Chlorkalk versetzt, färbt sich die Mischung rotviolett. Chlorkalk wirkt dabei als
ein Oxidationsmittel; es handelt sich um Calciumchlorid-hypochlorid Ca(ClO,Cl)2.
Der Leder- und Textilfarbstoff Anilinschwarz wird durch oxidative Polymerisation des Anilins in Gegenwart von Kaliumchromat hergestellt. Aufgrund der Länge des Chromophors wird das gesamte sichtbare Licht absorbiert; folglich ist der Farbstoff schwarz.
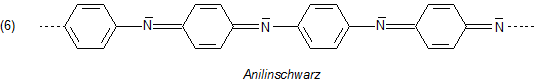
Anilin bildet die Grundlage der Verfahren zu den technischen Indigosynthesen.
Schließlich wurde Anilin ja durch Zersetzung von Indigo erstmals hergestellt.
Farbstoffe auf der Basis von Anilin spielen eine Rolle beim zolltechnischen Nachweis von Furfural, mit dem man Heizöl zur Unterscheidung von Dieselöl „markiert“. Auch die qualitativen Nachweise von Kohlenhydraten mit der Dünnschichtchromatographie sowie als Reagenzglasversuch beruhen auf dieser Reaktion.
Weitere Reaktionen, die zu Farbstoffen führen, haben die Diazotierung des Anilins zur Voraussetzung. Hierzu wird Anilin in saurem Milieu mit Natriumnitrit umgesetzt:
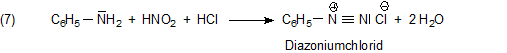
Das so entstandene Diazoniumsalz kuppelt mit anderen substituierten Aromaten wie Phenolen zu Farbstoffen. Die bekannteste
Farbstoffgruppe ist wohl die der Azobenzole.
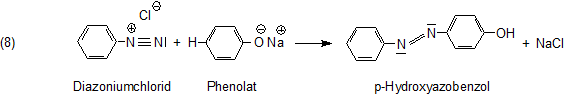
Sterisch handelt es sich um das trans-Isomere.
Ein anderes bekanntes Beispiel für farbige Azo-Verbindungen ist die Nachweisreaktion für Nitrit sowie für Stickoxide mit Saltzman-Reagenz.
Mit dem Azofarbstoff Kongorot wurden früher Kleider gefärbt.
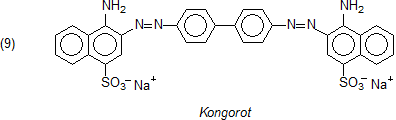
Aus der Geschichte sind die roten Hosen der französischen Infanteristen bekannt.
Weitere Texte zum Thema „Kohlenwasserstoffe“