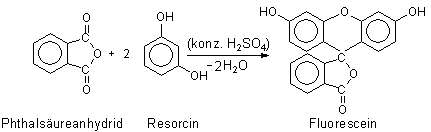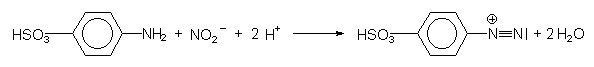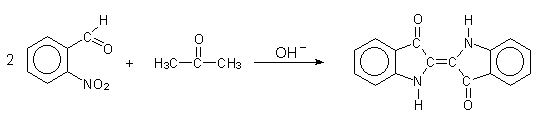Beispielhafte Synthesen farbiger Stoffe
Experimente:
Versuch: Aromatenprobe
Versuch: Synthese von Phenolphthalein
Versuch: Synthese von Fluorescein
Versuch: Synthese eines Azofarbstoffes
Versuch: Synthese von ß-Naphtholorange
Versuch: Substantivfärbung mit künstlichen Farbstoffen
Versuch: Synthese von Indigo
Versuch: Färben mit Berliner Blau
Versuch: Färben mit Anilinschwarz
1 Aromatenprobe (-> Versuch 1)
Bei der Aromatenprobe mischt man Chloroform mit dem Aromaten und lässt beide
zusammen in Gegenwart von wasserfreiem Aluminiumchlorid reagieren. Dabei bilden sich je nach
Aromaten charakteristische farbige Stoffe. Die Reaktion ist übrigens
eine Friedel-Crafts-Alkylierung und führt zur Reihe der Triphenylmethanfarbstoffe, zu denen
auch Phenolphthalein, Fluorescein und Kristallviolett gehören (s. u.).
Bild 2: Möglicher Farbstoff bei der Aromatenprobe mit Benzol
2 Synthese von Phenolphthalein
(-> Versuch 2)
Die (im sauberen Zustand) farblosen Verbindungen Phenol und Phthalsäureanhydrid verbinden
sich unter Schwefelsäureeinfluss zum zunächst farblosen Phenolphthalein, das mit
Laugen zu einem purpurfarbigen Stoff reagiert (Halochromie).
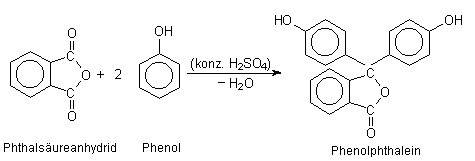
Bild 3: Synthese von Phenolphthalein
3 Synthese von Fluorescein (-> Versuch 3)
Die (im sauberen Zustand) farblosen Verbindungen Resorcin und Phthalsäureanhydrid
verbinden sich unter Schwefelsäureeinfluss zum gelben Fluorescein.
Dieser Stoff zeigt das Phänomen der Fluoreszenz.
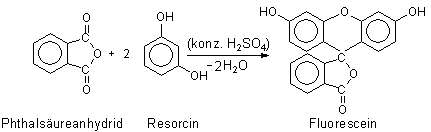
Bild 4: Synthese von Fluorescein
4 Synthese eines Azofarbstoffs (-> Versuch 4a und
Versuch 4b)
Mischt man geringe Mengen von Natriumnitrit in saurer Lösung mit farbloser
Sulfanilsäure und farblosem N-1-Naphthyl-ethylendiamin-hydrochlorid, so bildet sich rasch ein
intensiv purpurner Stoff. Die Mischung der beiden organischen Verbindungen ist als
Saltzman-Reagenz in der Wasser- und Luftanalytik bekannt. Sie dient
zum Nachweis von Nitrit-Ionen. Genau genommen weisen wir mit dieser Reaktion die im Sauren
aus Nitrit gebildeten Stickoxide nach.
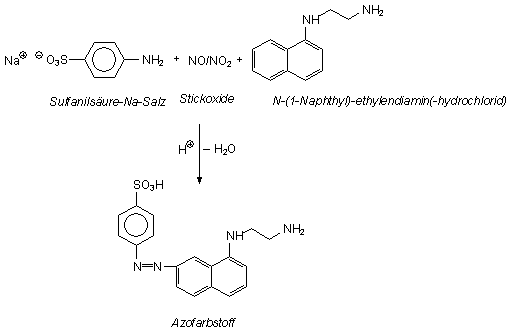 Bild 5: Bildung eines Azofarbstoffs
Bild 5: Bildung eines Azofarbstoffs
|
Eine Anmerkung:
Wir werden öfter gefragt, warum wir die Kupplungsreaktion nicht an dem Ring mit dem
Erstsubstituenten -NHR ablaufen lassen, wie es z. B. im Foliensatz des Fonds der Chemischen
Industrie gezeigt wird. Unsere Lenkung des zweiten Substituenten nach Stellung 7 hat vor allem
graphische Gründe.
Aber so ganz falsch ist die Formel auch nicht. Beim Naphthalin gelten nämlich nicht so
exakte Regeln wie beim Benzol. Wir folgen der Zweitsubstitutions-Regel 1 für Naphthalin:
Substituenten 1. Ordnung (vor allem -OH und -NHR), die in 1-Stellung stehen, dirigieren den
neu eintretenden Substituenten vornehmlich in p- bzw. o-Stellung (also 4 bzw. 2), bedingt aber
auch nach 5 und 7.
Lies hierzu: H. Beyer, W. Walter: Lehrbuch der Organischen Chemie, Hirzel-Verlag Stuttgart,
22 Auflage 1991; S. 630
|
Zu den Azofarbstoffen gehört auch Kongorot (-> Versuch 7).
Bei der technischen Synthese von Farbstoffen muss man beachten, dass sich eine Zwischenstufe, das
Diazonium-Ion, bildet:
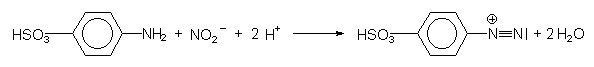
Dieses Ion kuppelt mit dem ß-Naphthol zum Azofarbstoff.
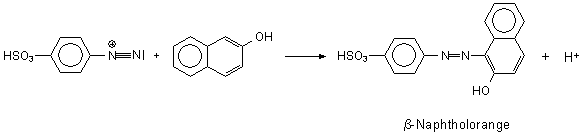
Das Diazonium-Ion neigt bei Temperaturen über 5 °C zur Abspaltung von Stickstoff. Deshalb
müssen die Synthesemischungen gut gekühlt werden (-> Versuch 4b).
5 Indigosynthese (-> Versuch 5)
Indigo war früher ein sehr teurer, natürlicher Farbstoff, der aus
Pflanzen gewonnen wurde, die in unseren Breiten nicht wuchsen. Um die Jahrhundertwende
entwickelte man die ersten, noch sehr komplizierten Synthesen. Heute gelingt die Synthese in
einer "Ein-Topf-Reaktion" auch in der Schule: Hierbei lässt man nahezu farblosen
o-Nitro-benzaldehyd mit Aceton in Gegenwart von Natronlauge reagieren. Es bildet
sich augenblicklich dunkelblauer Indigo.
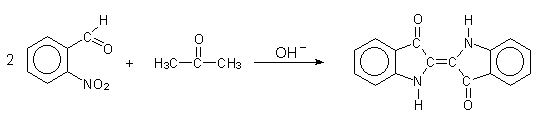
Bild 6: Indigosynthese
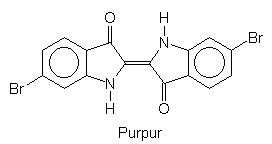
Substituiert man zwei H-Atome durch Brom, so erhält man den berühmten
Farbstoff der Purpurschnecke. Dies zeigt, wie leicht Farbeigenschaften bestimmter
Moleküle beeinflussbar sind.
Weitere Synthesen aus kleineren Molekülen betreffen Berliner Blau (->
Versuch 8) und
Anilinschwarz (-> Versuch 9). Diese werden in anderen
Zusammenhängen besprochen.
Weitere Texte zum Thema „Farbstoffe und Färben“
Diese Seite ist Teil eines großen Webseitenangebots
mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 14. April 2014, Dagmar Wiechoczek