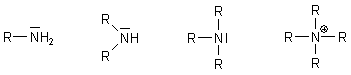
Amine - Substitutionsprodukte des Ammoniaks
Bei den Aminen sind Wasserstoffatome des Ammoniaks durch Alkyl- oder Aryl-Reste ausgetauscht. In Abhängigkeit von der Anzahl der substituierten Wasserstoffatome gibt es Mono-, Di- und Trialkylaminen.
Man kann auch sagen, dass Monoalkylamine primäre Amine, Dialkylamine sekundäre Amine und Trialkylamine tertiäre Amine sind. Die vierfach substituierten Amine sind quaternäre Amine.
Es gibt viele Alkylamine. Typisch für sie ist der fischige Geruch. Hier sind vor allem Methylamin oder Ethylamin zu nennen.
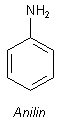
Ein Beispiel für ein aromatisches Amin (Arylamin) ist Anilin:
Wie der Stickstoff in den Aminen gebunden ist
Das Stickstoffatom eines Alkylamin ist sp3-hybridisiert und bildet daher
ein perfektes Tetraeder. Dabei weisen die drei Substituenten (R) und das freie Elektronenpaar jeweils
in eine Ecke des Tetraeders.
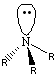
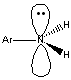
Ganz anders sieht die Situation im aromatischen Amin aus. Hier ist das Stickstoffatom sp2-hybridisiert und daher planar. Sein freies Elektronenpaar befindet sich jetzt in einem p-Orbital:
Die Basizität von Alkyl- und Arylaminen
Auf Grund des freien Elektronenpaars des Stickstoffatoms sind Amine ebenso wie Ammoniak Basen.
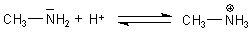
Ihre Basenstärke wird dabei durch den Substituenten beeinflusst. So haben Arylamine eine wesentlich
geringere Basenstärke als Alkylamine.
Darüber gibt der pKa-Wert Aufschluss. Dies ist der pH-Wert, bei dem Säure und
korrespondierende Base gleich konzentriert vorliegen. Je niedriger der Wert ist, desto mehr Protonen
sind nötig, um das Amin zu protonieren. Ein niedriger pKa-Wert bedeutet somit geringe Basizität.
| Ammoniak | Methylamin | Dimethylamin | Trimethylamin | Anilin | |
| pka | 9,25 | 10,66 | 10,73 | 9,81 | 4,63 |
Der Grund hierfür liegt in der Struktur der Moleküle.
Vergleicht man die Alkylamine mit Ammoniak, so fällt die stärkere Basizität der Amine auf. Das liegt am (+I)-Effekt der Alkylgruppen. Je mehr Alkylgruppen das Stickstoffatom trägt, desto basischer sollte es sein. Das gilt aber nur für den Übergang vom primären zum sekundären Amin. Das tertiäre Amin dagegen ist weniger basisch. Der Grund ist, dass die drei Alkylgruppen den Zutritt zum nichtbindenden Elektronenpaar behindern.
Beim Anilin fällt der niedrige pKa-Wert auf; das heißt, dass es eine äußerst schwache Base ist. Zunächst einmal befindet sich das nichtbindende Elektronenpaar des Stickstoffs in einem atomkernnäheren 2p-Orbital. Hinzu kommt, dass es darüber hinaus auch in die Mesomerie des Benzolrings eingebunden ist. Das zeigen die folgenden Grenzstrukturen.
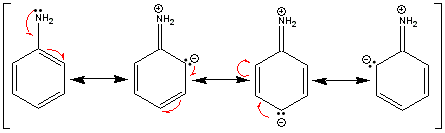
Das freie Elektronenpaar kann also über den aromatischen Ring delokalisiert werden, wodurch es für eine Protonierung schwerer zugänglich ist. Erfolgt die Protonierung, verliert das Molekül diesen stabilisierenden Resonanzeffekt. Somit bevorzugt das Molekül die unprotonierte Form.
Wie gewinnt man Amine?
Zur technischen Synthese der Amine gibt es viele Möglichkeiten, von denen hier nur die einfachsten
erwähnt werden sollen. Klassisch ist die Reduktion von Nitroalkanen (R-NO2). Das gilt vor
allem für die aromatischen Amine. Man kann aber auch Alkylhalogenide mit Ammoniak umsetzen.
NH3 + CH3I ———> CH3-NH2 + HI
Es entstehen Gemische von Aminen, die noch destilliert werden müssen.
Biochemische Bildung der Amine
Amine entstehen auch in der Natur. Sie werden vor allem durch Decarboxylierung von Aminosäuren erzeugt.
Die hierbei entstehenden primären Amine nennt man auch biogene Amine. Sie entstehen auch bei der
bakteriellen Zersetzung von Eiweiß. Erinnert sei an den Fischgeruch, der auf der Bildung von
Methylamin aus der Aminosäure Glycin beruht.
Andere biogene Amine sind für verschiedene Prozesse im Organismus relevant. Histamin (gebildet
aus Histidin) ist wichtig bei der Immunreaktion. Es ist auch im Wespen- oder Bienengift sowie in der
Brennnessel enthalten.
Wichtige Amine, die aus Tryptophan gebildet werden, sind die Neurotransmitter Serotonin und das
Zirbeldrüsenhormon Melatonin. Tyramin (gebildet aus Tyrosin) ist für die Muskelkontraktion zuständig.
Andere bekannte biogene Amine sind die Neurotransmitter Dopamin und das Hormon Adrenalin.
Wofür sind Amine wichtig?
Amine haben in der Industrie eine vielfältige Anwendung gefunden. Beispiele sind die Herstellung
von Azo-Farbstoffen, von Kunststoffen
wie den Polyamiden und Polyurethanen sowie von Tensiden, zu denen auch die in der Zahnpflege genutzten
Aminfluoride gehören. Aber auch viele Medikamente wie das
Paracetamol beruhen letztlich auf Aminen. Eine Rolle spielen Amine auch
bei der Gaswäsche in Raffinerien.
Wichtig sind auch die biogenen Amine, die vor allem aus der Pflanzenwelt stammen. Es handelt sich
um die Alkaloide. Sie wirken nicht nur als wichtige Heilmittel
(wie das Morphium), sondern auch als Rauschgifte. Auch Stimulantien wie das Coffein sind hier zu nennen.
Synthetische Drogen wie die Amphetamine und andere Weckamine verstärken die physiologische Wirkung
biogener Amine ("Designer-Drogen").
Gerade hier liegt auch die Gefahr des Missbrauchs. Denn bei dem N-Methylderivat handelt es sich um eine Droge, die in der Szene auch als Speed bekannt ist.
Weitere Texte zum Thema „Ammoniak, Amine und Säure-Amide“