Prof. Blumes Tipp des Monats Januar 2006 (Tipp-Nr. 103)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Zucker - ein Zahnkiller? Wie Säuren Zähne
gefährden und was man dagegen tun kann
Nicht nur zu Weihnachten gibt es viele Schlickereien, wie man hier in Ostwestfalen ("OWL") sagt. Zur Übersetzung: Kinder schlickern, wenn sie Süßigkeiten naschen. Macht das nicht die Zähne krank? Ja. Um das nachzuweisen, brauchen wir vor allem erst einmal Zähne. Glücklicherweise hilft uns die Natur.
Die ersten Zähne fallen als Milchzähne bald aus und werden gesammelt. Danke an den siebenjährigen Kilian, dass er uns seinen ersten Zahn zum Experimentieren geschenkt hat! (Für mich stellt sich übrigens immer wieder die Frage: „Warum eigentlich bewahrt man die ersten Zähnchen überhaupt auf?“)
Zähne gehören in eine Mineraliensammlung
Zähne sind mit hartem Zahnschmelz überzogen. Der ist aus Apatit aufgebaut. Apatit
ist auch als Mineral in der Natur zu finden und wird in reiner Form sogar als schleifbarer Halbedelstein
geschätzt. Sein Name kommt vom griechischen Wort apatao, Täuschung. Damit umschreibt man die
unglaublich vielen Erscheinungsformen und Farben, in denen dieses Mineral vorkommt. Es handelt sich -
wie man es in manchen Büchern noch lesen kann - um "ein wasserfreies Phosphat mit fremden Anionen".
Hier ist seine chemische Formel:
| Ca5(PO4)3(OH,Cl,F) |
Die veraltete Schreibweise für Apatit ist dann auch 3 Ca3(PO4)2 ·
Ca(OH,Cl,F)2. (Der Punkt zwischen den Formeln wird als "mit" gelesen.) Dieser Formel kann man allerdings
nicht entnehmen, dass es sich nicht etwa um ein Doppelsalz, sondern um eine Verbindung mit einheitlichem Kristallgitter
handelt. Also ist Ca5(PO4)3(OH,Cl,F) die einzig richtige Formulierung.
Der Klammer-Ausdruck (OH,Cl,F) in der Formel besagt, dass sich Hydroxid- und Halogenid-Ionen beliebig
austauschen lassen, ohne dass sich die Eigenschaften des Apatits nennenswert verändern. Allerdings meinen viele,
dass sich der Einbau von Fluorid-Ionen ins Kristallgitter härtend auswirkt. Das ist nicht richtig, wie wir unten
erfahren werden.
Die hexagonalen Kristalle von Apatit sind relativ hart, ihre Mohshärte beträgt 5. Wie Calciumphosphat sollte auch Apatit chemisch ziemlich stabil ("inert") sein. Das stimmt nur begrenzt! Haben Sie schon mal in eine frische Zitrone gebissen? Danach fühlen sich Ihre Zähne ganz rau an. Offensichtlich greifen manche Säuren den Zahnschmelz ganz locker an.
Zähne werden von Säuren bedroht
Vor allem Säuren wirken auf sie ein. Da sind zum Beispiel die Zuckersäuren wie die Gluconsäure,
die bei der Oxidation von Zuckern entstehen. Dazu gibt es noch die Citronensäure
und die Milchsäure.
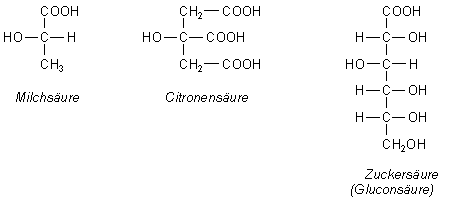
Diese Säuren haben alle eines gemeinsam: Sie bilden als mehrzähnige Liganden mit Calcium-Ionen chemische Komplexe, die Chelate.
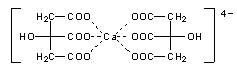
|
Versuch 1: Säuren greifen Zähne an
Ergebnis: Nach einem Tag ist der Zahnschmelz zersetzt. Im Glas schwimmen einige häutchenartige Eiweißreste (-> Bild). |
| Klick mich an! |
 |
| Bild 1: (Fotos: Daggi) |
Was wenig bekannt ist: Der Schmelz auch gesunder Zähne ist mit einer filmartigen Struktur bedeckt, die sich
beim Zersetzen des Zahns ablöst. Die Eiweißreste, die in der Lösung schwimmen, sind somit dieses Schmelzoberhäutchen.
Zurück bleibt das Zahnbein, das Dentin. Dieses ist eine knochenartige Substanz und
wird unter anderem auch aufgrund des höheren Gehalts an organischer Substanz von unserer 30%igen Citronensäure
weniger angegriffen. Das gilt aber nicht für die Bakterien, die mit hydrolytisch wirkenden Enzymen gerade die
organische Substanz attackieren und Löcher bohren.
Wenn wir auch das Dentin zersetzen wollen, müssen wir die Citronensäure höher konzentrieren. Am besten geht es mit einer sirupartigen Säurelösung.
In vielen Süßigkeiten ist nicht nur Zucker, sondern es sind von vornherein auch Säuren wie Citronen- oder Apfelsäure enthalten. Man spricht von Genusssäuren.
|
Versuch 2: Nachweis von Säuren in Süßigkeiten
Ergebnis: Nach kurzer Zeit färben sich die Indikatorlösungen rot. |

Bild 2: (Foto: Daggi)
Das sind manchmal so große Säuremengen, dass der normalerweise schwach alkalische Speichel die nicht mehr
neutralisieren kann. Beispielsweise wurden 2004 vom Bielefelder Chemischen Untersuchungsamt in einem
"Schleckpulver" sogar 21,8 Masse% Citronensäure gefunden! (Zum Vergleich: Der Säuregehalt von natürlichem
Zitronensaft beträgt etwa 5 %.) Dieses als Dynamitstange verpackte Schleckpulver hat die gleiche Konzentration
von Citronensäure wie handelsübliche Haushaltsgeräte-Entkalker. Die Schleck-Tester sind vor Schreck auf den
Rücken gefallen und hatten lange Zeit eine pelzige Zunge. Diese "süße" Mischung müsste deshalb den Warnhinweis
"Reizend" (Xi) tragen. Das Ganze wird noch durch den Zuckergehalt verstärkt - wegen der Zuckersäurebildung im Mund.
Zähne werden von Bakterien bedroht
Jeder kennt die Zahnbeläge, die Plaques. In denen leben bestimmte Bakterien und lösen die Karies aus. Der
Begriff Karies steht für Zahnfäule, die zumindest das äußere Bild der kranken Zähne anschaulich beschreibt.
Aber letztlich sind es die sauren Stoffwechselprodukte der Karies-Bakterien, die aggressiv wirken. Das sind genau die oben angesprochenen Säuren wie Zuckersäure, Citronensäure und die Milchsäure.
Gegen die Säureeinwirkung können wir einiges unternehmen:
| 1 | Am besten verzichten wir ganz auf saure Bonbons. |
| 2 | Mit dem Zähneputzen sollten wir nach dem Verzehr von sauren Speisen etwas warten, damit sich der Zahnschmelz regenerieren kann. Dabei hilft ein Calcium-haltiges Mineralwasser. Damit können wir zugleich auch die Säuren ausspülen. |
| 3 | Wir putzen unsere Zähne mit Fluorid-haltigen Cremes. |
Fluoride gegen Karies
Gegen Karies mischt man den Zahnpflegemitteln Fluorid bei. Das können wir mit Hilfe eines Experiments,
das E. Diemann vorschlägt, nachweisen (-> Versuch).

Bild 3: Nachweis von Fluorid-Ionen in Zahnpasta (Bedingungen siehe Versuch)
(Foto: Daggi)
Wie wirken Fluoride überhaupt? Lange Zeit nahm man an, dass Fluorid-Ionen in das Kristallgitter des Apatits
eingebaut werden und so den Zahnschmelz härten. Heute weiß man, dass die Fluorid-Ionen vor allem den
Stoffwechsel der Karies auslösenden Bakterien (Mutans-Streptokokken und Lactobazillen)
hemmen und auf diese Weise die Säureproduktion unterbinden.
Wie aber bringt man das Fluorid an den Zahnschmelz, so dass es direkt am Ort des Geschehens ist und vor allem auch längere Zeit bleibt? Früher nahm man Natriumfluorid oder Natriummonofluorphosphat, deren Effekt jedoch begrenzt war und erst einsetzt, wenn man für bedenklich hohe Konzentrationen von Fluorid sorgt. (Denn Fluoride beeinflussen auch den menschlichen Stoffwechsel!) Den Durchbruch in der Karies-Prophylaxe brachten erst die Aminfluoride. Deren Konzentration ist mit 500 ppm (in Kinderzahnpasta) und mit 1250 ppm (in Pasten für die Großen) sehr gering.
Aminfluoride sind auf den ersten Blick recht komplizierte Verbindungen. Hier ist die Strukturformel von Olaflur, einem Aminfluorid, das in Aronal oder Elmex enthalten ist.
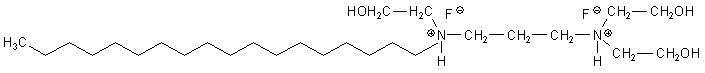
Dieses Aminfluorid ist ein von der Ölsäure abgeleitetes Fluorid einer quarternären Ammoniumbase mit dem
Namen "Trihydroxyethyl-octadecyl-diaminopropan". Man findet auch die kompliziertere Bezeichnung
N'-Octadecyl-trimethylendiamin-N,N,N'-tris(2-ethanol)-dihydrofluorid, die den Regeln der IUPAC-Nomenklatur
eher folgt. Man spricht von Hydrofluorid, weil bei der Salzbildung ein HF-Molekül an die Base addiert wird.
Zum Vergleich: Ammoniumchlorid NH4Cl kann auch als Ammoniak-Hydrochlorid bezeichnet werden.
So wirken Aminfluoride
Aminfluoride sind Tensid-artig aufgebaut, also wie Seifenmoleküle. Genau genommen muss man sie mit Invertseifen
vergleichen. Dafür sind ihr positiv geladener hydrophiler Kopf und der hydrophobe Schwanz verantwortlich. Diese
Moleküle reichern sich wie alle Tenside gezielt an Oberflächen an, also auch auf dem Zahnschmelz, und bilden dort
monomolekulare Schichten. In den Aminfluoriden ist das Fluorid-Ion an den protonierten Aminteil gebunden, der durch
seine Affinität zum polaren Zahnschmelz das Fluorid an die Zahnoberfläche transportiert und dort festhält. Auf
diese Weise wird das Fluorid an der Zahnoberfläche - dort, wo es gebraucht wird - in idealer Weise konzentriert.
Ist aber Olaflur nicht selbst eine Säure? Es kann ja Protonen abgeben. Vergleichen Sie es nur mit
Ammoniumchlorid!
Dieser Einwand ist richtig. Der saure Charakter von Olaflur stört aber nicht! Gerade im Gegenteil: Die leichte
Anätzung durch diese Brönsted-Säure bewirkt zwar, dass sich Apatit oberflächlich zersetzt. Das wird aber zugleich
wieder durch die Ausfällung von antibakteriell wirkendem, schwerlöslichem und zugleich sehr hartem
Calciumfluorid ersetzt. Seine Mohshärte beträgt zwar nur 4, das reicht aber zum
Beißen aus. Und dazu schützt es noch, weil es die angreifenden Bakterien mit Fluorid-Ionen geradezu überschwemmt.

Bild 4: Flussspatkristalle
(Foto: Blume)
Manchmal liest man auch, dass Meridol auch Zinn(II)-fluorid SnF2 enthält. Diese Substanz sorgt für das
Verschließen von feinen Haarrissen im Zahn. Bei Kontakt mit dem alkalischen Speichel und Zahnschmelz fällt nämlich
schwerlösliches Zinnoxid/hydroxid (SnO · Sn(OH)2) aus. Damit werden übrigens
auch Gläser versiegelt.
Last but not least
Mit Citronensäure lässt sich Zahngold recyclen. Hat jemand noch Opas anlässlich seines zweiten Gebisswechsels
extrahierte Zähne herumliegen und möchte das darin enthaltene Zahngold versilbern (also gewinnbringend unter die
Leute bringen), so braucht er sie nur in Citronensäurelösung legen - wie in Versuch 1 beschrieben. Allerdings
verwenden wir eine wesentlich höher konzentrierte, also eine sirupartige Lösung. Dann sollte nach zwei-drei
Tagen das Gold frei geätzt sein.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 08. Januar 2012, Dagmar Wiechoczek