Prof. Blumes Tipp des Monats Dezember 2002 (Tipp-Nr. 66)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
 |
| Bild 1 (Foto: Blume) |
Wie entstehen die Flussspat-Spaltoktaeder?
Ein Vorschlag zur Arbeit mit Kristallmodellen
Bald ist Weihnachten! Auf Mineralienbörsen und auf dem Weihnachtsmarkt werden für wenig Geld prächtige Flussspatoktaeder angeboten. Merkwürdig: Flussspat kennt man im Allgemeinen doch nur in würfeliger Tracht!
 |
 |
| Bild 2: Würfel als natürlich gewachsene Flussspatkristalle
(Fundort: Xianghuapu-Mine, Hunan, China)
Bild 2: Spaltoktaeder von Flussspat (Herkunft: Illinois, USA) (Fotos: Blume) |
Beim genauen Nachfragen erfährt man, dass es sich um
künstlich hergestellte Spaltoktaeder handelt. Wie macht man die? Denn wenn man mit einem
vorsichtigen Hammerschlag Kochsalzkristalle spaltet, erhält man
bekanntlich immer wieder Würfel oder rechtwinklige Quader. Das sollte beim Flussspat
eigentlich nicht anders sein, oder?
|
Versuch: Spalten von Natriumchlorid- und von Flussspatkristallen
Ergebnisse
|
 |
 |
 |
| Bild 3: Spaltungsversuch mit Flussspatwürfeln
(Fotos: Daggi) |
Versucht man also, würfelige Flussspatkristalle zu spalten, erhält man stets mehr oder
weniger schöne Oktaeder statt der erwarteten Würfel. (Meistens gelingt dem
Ungeübten aber nur das schräge Abspalten der spitzen Würfelecken. Die bekannten
Spaltoktaeder, die auf Mineralienbörsen angeboten werden, sind offenbar von sehr
geschickten Künstlern hergestellt worden. Vermutlich gibt es dazu auch schon einen
Apparat, der auf den Mittelpunkt einer Würfelfläche gleichmäßig Druck ausübt. Dann
knallen mit einem Mal alle vier Ecken weg.)
Um das unterschiedliche Spaltverhalten zu verstehen, ist ein Blick ins Kristallgitter notwendig.
Die Elementarzelle des Flussspats
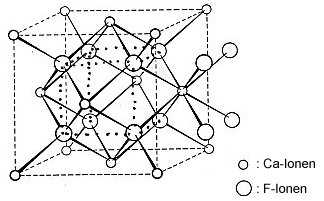
Bild 4: Elementarzelle des Fluorit-Gitters
Der Fluorit oder Flussspat ist chemisch Calciumfluorid, CaF2. (Achte auf die
Schreibweise von Fluorit oder Fluorid!) Diese Verbindung ist eine Salzart und besteht wie alle Salze
aus Ionen, also aus elektrisch geladenen Teilchen. Wie die Formel besagt, kommen auf ein zweifach positiv
geladenes Calcium-Ion Ca2+ (Kation) zwei negativ geladene Fluorid-Ionen F- (Anionen).
Damit ist der Kristall nach außen hin elektrisch neutral.
Die Ionen sind im Kristall nicht beliebig verteilt. Im Fluorit-Gitter ist jedes Calcium-Ion von 8 Fluorid-Ionen umgeben, und jedes Fluorid-Ion von 4 Calcium-Ionen. Die 8 Fluorid-Ionen bilden um das Calcium-Ion einen Würfel, die 4 Calcium-Ionen um das Fluorid-Ion ein Tetraeder.
Ein Hinweis: Wenn man genau hinsieht, erkennt man, dass alle im Würfel befindlichen Ionen zusammen ein Rhombendodekaeder bilden. Deshalb findet man (wenn auch selten) Flussspat-Rhombendodekaeder. Diese bilden auch abgestumpfte Formen mit Sechsecken, wie das folgende Bild zeigt. Lies hierzu diese Webseite.
 |
| Bild 5: Eine Gruppe von Flussspat-Hexaedern (Fundort: Artaishan-Mine,
Xinjiang, China)
(Foto: Blume) |
Zum besseren Verständnis des Spaltverhaltens von Flussspatwürfeln sollte man
ihre Elementarzelle wie folgt zeichnen:
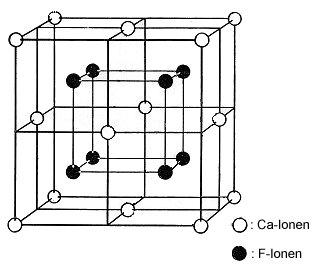
Bild 6: Andere Darstellung der Elementarzelle des Fluorit-Gitters
Der Abbildung entnimmt man, dass die Calcium-Ionen einen flächenzentrierten
Würfel bilden. Die Fluorid-Ionen sitzen in der Mitte der Achtelwürfel der
Elementarzelle. Man erkennt, dass sie ebenfalls eine Würfelstruktur bilden.
Die Würfelflächen dieser beiden Untergitter verlaufen parallel zu den Würfelflächen
der Elementarzelle. (Im dreidimensionalen Kristallmodell sollte man die entsprechenden
Gitterpunkte mit einem farbigen Band verbinden.)
Das Spalten der Kristalle
Wenn man auf einen Kristall schlägt, werden seine Teilchenschichten kurzfristig verschoben.
Wie sich das auswirkt, kann man ebenfalls am besten mit dreidimensionalen Modellen
zeigen. Dazu blickt man senkrecht auf eine Würfelfläche, so wie wir es auf unseren
folgenden Grafiken zeigen.
Wir vergleichen die Auswirkungen eines Schlags auf die Kristalle von Natriumchlorid und von Flussspat.
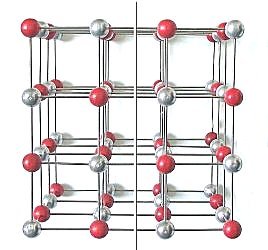
1 Die Würfelflächen von Natriumchlorid enthalten in alle Richtungen alternierend positiv geladene Natrium-Ionen und negativ geladene Chlorid-Ionen. Nach dem Schlag stehen sich kurzfristig längs der Verschiebungsschicht alle gleichsinnig geladenen Ionen gegenüber. Das zeigt das folgende Bild.
 |
 |
| Bild 7: Modell zur Erklärung der Spaltung eines
Kochsalzkristalls längs seiner Würfelflächen
Silberne Kugeln: Na-Ionen, Rote Kugeln: Chlorid-Ionen (Grafik: Blume) |
Die Folge ist die gegenseitige elektrostatische Abstoßung der Ionen und die explosionsartige
Auftrennung des Gitters. Es entstehen Spaltwürfel und -quader.
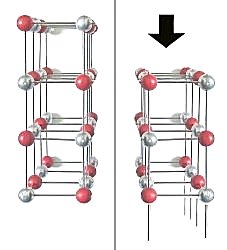
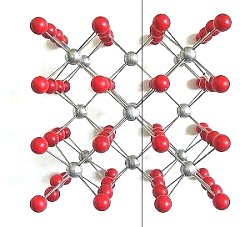
2 Im Gegensatz zum Kochsalz-Gitter enthalten die Würfelflächen des Gitters von Flussspat jeweils nur eine Ionenart (-> Bild 6). Beim Verschieben längs der Würfelflächen verändert sich nichts an der elektrostatischen Anziehung oder Abstoßung. Deshalb laufen die Spaltflächen des Fluorit-Gitters nicht zu seinen Würfelflächen parallel. Das zeigt das folgende Bild.
 |
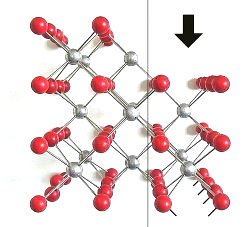 |
| Bild 8: Modell zur Erklärung der Nichtspaltbarkeit eines
Flussspatkristalls längs seiner Würfelflächen
Silberne Kugeln: Ca-Ionen, Rote Kugeln: Fluorid-Ionen (Grafik: Blume) |
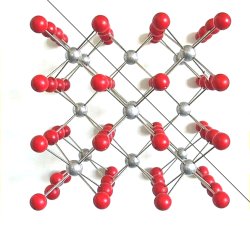
Dagegen kommt es beim Verschieben parallel zu den Oktaederflächen zu einer
Gegenüberstellung ganzer Reihen von gleichsinnig geladenen Ionen und damit zu
gegenseitiger Abstoßung, wie das folgende Bild zeigt.
 |
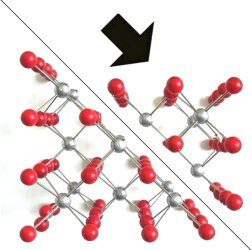 |
| Bild 9: Modell zur Erklärung der Bildung von Oktaederflächen
bei der Spaltung eines Flussspatkristalls
(Grafik: Blume) |
Dass das Modell in Bild 9 nicht nur in atomaren Dimensionen, sondern auch im Makroskopischen der Realität entspricht,
zeigt das folgende Bild von einem Flussspat-Kristall mit Spaltrissen. Diese sind entstanden, als der Kristall zum Anätzen
zunächst in konzentrierte Salzsäure gelegt wurde und danach wohl zu rasch getrocknet worden war.
| Klick mich an! |
 |
| Bild 10: Flussspat-Kristall mit Spaltrissen
(Foto: Blume) |
Man schneidet so beim Spalten die Ecken der Würfel ab; ein Oktaeder entsteht. Beim
Versuch ist man überrascht, wie leicht das geht. (Die Bezeichnung Spat steht übrigens immer
für besonders leicht spaltbare Mineralien; man denke zum Beispiel an
Kalkspat.) Zum Oktaeder sei noch nachgetragen,
dass auch dieser eine (sehr seltene) Wuchsform natürlicher Fluorit-Kristalle ist.
 |
| Bild 11 (Foto: Blume) |
Beim Erhitzen spaltet der CaF2-Kristall übrigens auch parallel zu den Würfelflächen.
Hierbei werden ja keine Gitterflächen verschoben, sondern zum Schwingen gebracht, bis
sie getrennt werden. Das passiert leider leicht, wenn man die Thermolumineszenz
demonstrieren will und den Kristall dabei zu hoch erhitzt.
Was passiert mit den offenen Bindungen an den Kristallspaltflächen?
Das wird immer von Schülern gefragt und muss deshalb erklärt werden. Hier lagern sich Luftbestandteile
an. Wir müssen uns die frisch gebrochenen Oberflächen wie mit einem Pelz von Molekülen überzogen vorstellen.
Das können zunächst unpolare Teilchen wie die Moleküle von Sauerstoff, Stickstoff oder CO2 sein.
Wichtiger sind aber polare Moleküle wie die von Wasser. Die Bindungen beruhen auf Ion-Dipol-Wechselwirkungen.
Bei unpolaren Teilchen werden die Dipole durch die Ladungen der Ionen des Kristalls erst induziert.
PS: Fluorit-Würfel gibt es nicht nur in China, sondern sind auch auf der Halde der
Schwerspatgrube Clara im Kinzigtal/Schwarzwald zu finden. Die chinesischen Fluoritkristalle haben
wir auf der Mineralienbörse in Gütersloh von Yuwen Li aus 25746 Heide gekauft.
 |
| Bild 12 (Foto: Blume) |
Rüdiger Blume
Literatur
[1] W. Kleber: Einführung in die Kristallographie. VEB Verlag Technik, Berlin 1962.
[2] R. Winderlich, W. Peter: Lehrbuch der Chemie. Friedr. Vieweg & Sohn,
Braunschweig 1957.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 08. April 2010, Dagmar Wiechoczek