
Polpapier und Elektrolyse von Phenolphthalein-haltigen NaCl-Lösungen
Experimente:
Klicke hier
Die Indikatoreigenschaften von Phenolphthalein nutzt man
zur Herstellung von Polpapier. Darunter versteht man mit Phenolphthalein- und Kochsalzlösung
imprägniertes Papier, mit dem man die Polrichtung einer Gleichstromquelle ermitteln kann. Feuchtes Polpapier zeigt
nämlich durch Purpurfärbung den Minuspol an.

Bild 1: Polpapier
(Fotos: Blume)
Da muss etwas passiert sein, was Hydroxid-Ionen produziert. Der Grund ist, dass am Minuspol (bei der
Batterie die Kathode) folgender Prozess abläuft:
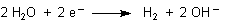
Diese Reaktion kann man auch anhand der Elektrolyse einer Natriumchloridlösung, die
Phenolphthalein enthält, zeigen. Dabei färbt sich der Raum um den Minuspol wie erwartet rot. Der Raum um den
Pluspol bleibt farblos, trübt sich aber.

Bild 2: Elektrolyse einer Phenolphthalein-haltigen Natriumchlorid-Lösung.
Links ist der Pluspol, rechts der Minuspol
(Foto: Daggi)
Die Trübung rührt von Oxidations- und Chlorierungsprodukten des Phenolphthaleins her. Denn an der Anode
entstehen Sauerstoff und Chlor.
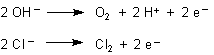
Diese Produkte sind schwer löslich. Hinzu kommt als Grund für die Trübung noch die Bildung der Protonen im Anodenraum in Frage. Die beruht auch auf der Reaktion des entstandenen Chlors mit dem Wasser.
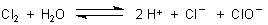
(Dieses Gleichgewicht ist bekannt im Zusammenhang mit dem so genannten Domestosproblem.)
Wegen des sauren Milieus liegen Phenolphthalein und seine relativ unpolaren Oxidationsprodukte nicht mehr dissoziiert vor. Folglich sind diese Substanzen in Wasser schwerlöslich und verursachen die Trübung.
In diesem Zusammenhang sei daran erinnert, dass Phenolphthalein von vornherein schon wenig löslich ist und sich nur in einer Mischung von Wasser und Ethanol löst.
Insgesamt ist der Anodenraum wohl ein recht „ungemütliches“ Milieu für kompliziert gebaute organische Moleküle wie das Phenolphthalein…
Weitere Texte zum Phenolphthalein