Molekulare Prozesse bei der Feuersteingenese
Experimente
Versuch: Auflösen von Feuersteinpulver durch Alkalien;
Nachweis von Siliciumdioxid
Versuch: Fällen von Kieselgel aus einer Silicatlösung
Die im Folgenden beschriebenen Stadien durchläuft die Kieselsäure, wenn man ihr ausreichend
Zeit zur Umgruppierung der Bausteine sowie zur Bindungsverknüpfung lässt. In der Natur dauert
der Vorgang bis zur Ausbildung von gallertartigem Gel und der Verfestigung der Strukturen nur
wenige Tage. Dies zeigen moderne Tiefseebohrungen, mit deren Hilfe man frische Sedimente
untersucht hat.
Wenn man den Vorgang im Labor durch Zugabe von Säure beschleunigt, erhält man glasartig
hartes (allerdings noch nicht hochpolymeres) Kieselsäuregel schon innerhalb weniger Minuten.
Diesen Versuch kann man mit Wasserglas und Essig- oder Salzsäure selber durchführen
(siehe Experimente, V 4 F).
Polymerisation von Kieselsäure
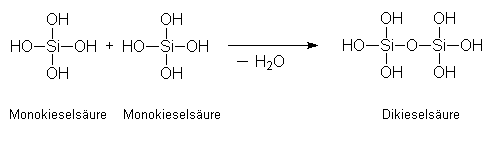
Die frisch gebildete Kieselsäure H4SiO4 ist wenig beständig und neigt unter Wasserabgabe zur
Polymerisation (Kondensation). Voraussetzung hierfür ist zunächst eine Zusammenlagerung der
Kieselsäuremoleküle unter Ausbildung von lockeren Wasserstoffbrückenbindungen. Aus diesen
Addukten heraus werden Wassermoleküle abgespalten:

Zur Vereinfachung der Formelbilder verwendet man Tetraedersymbole, die jeweils für ein vierbindiges Siliciumatom stehen.
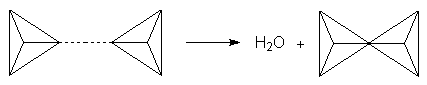
Die Zusammenlagerung setzt elektrisch ungeladene Moleküle voraus. Diese liegen aber primär noch nicht vor, da bei der basischen Zersetzung von Diatomit negativ geladene Silicat-Anionen entstehen, z. B.:
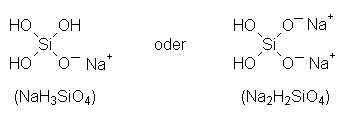
Da gleichnamig geladene Teilchen sich abstoßen, polymerisieren Silicat-Anionen nur sehr
langsam. Andererseits fördert dies die Auflösung von Diatomit, da der molekulardisperse Zustand
der Kieselsäure dadurch stabilisiert wird. (Eine konzentrierte Lösung von niedermolekularen
Natriumsilicaten ist unter dem Namen "Wasserglas" käuflich.)
Säuren, die stärker sind als die Kieselsäure (wie die Kohlensäure), übertragen positiv geladene
Wasserstoff-Kationen auf die negativ geladenen Silicat-Anionen und bilden elektrisch neutrale
Kieselsäuremoleküle. Formal gilt:
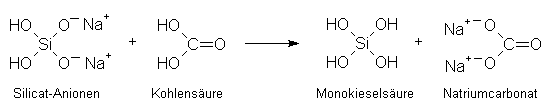
Diese freigesetzten Monokieselsäure-Moleküle lagern sich sehr rasch zu Kolloiden zusammen, in
denen dann langsam die Polymerisation einsetzt. Somit fördern nicht zu starke Säuren die
Polymerisation der Kieselsäure. Das Maximum für die Polymerisation liegt unter natürlichen
Bedingungen zwischen den pH-Werten 4 und 7. Diesen pH-Bereich weisen die meisten
Gewässer und Meere auf.
Bei weiterer Zusammenlagerung von Kieselsäuremolekülen und Wasserabspaltung bilden sich zunächst
lineare Moleküle mit zunehmender Größe. Jedes Si-Atom trägt noch zwei freie OH-Gruppen. Diese Ketten
lagern sich (entweder unter Ausbildung von Wasserstoffbrückenbindungen locker oder teilweise unter
Wasserabspaltung irreversibel gebunden) zu Flächen und dreidimensional vernetzten Aggregaten zusammen,
in deren Poren sehr viel Wasser gespeichert ist.
Parallel zu diesen chemischen Vorgängen beobachtet man charakteristische Veränderungen der mechanischen und optischen Eigenschaften der Kieselsäurelösungen:
| A. | Die kolloidalen Lösungen beginnen wegen der Lichtstreuung bläulich zu opalisieren (TYNDALL-Effekt). |
| B. | Wegen der durch chemische Bindungen hervorgerufenen Starrheit wird das Gel immer weniger kompressibel, so dass sich die Poren bei zunehmender Entwässerung wieder erweitern müssen. Das Gel schrumpft somit bei dem Erstarrungsprozess bemerkenswert wenig. Am besten beschreibt man gealtertes Kieselsäuregel deshalb als ein Gebäude aus sehr dünnen Wänden mit feinsten Quervernetzungen. Aufgrund der Starrheit bilden sich bei fortschreitender Entwässerung Gasblasen, die den Raum des Wassers einnehmen. Dadurch wird das Gel trübe bis weiß. |
| C. | Da die Entwässerung notwendigerweise von innen nach außen verlaufen muss, ist der Feuerstein innen schon "gereift und trägt nach außen hin noch seine weiße Wachstumsrinde. Die weiße Rinde, die häufig mit der alterungsbedingten "Patina" verwechselt wird, besteht nicht aus kalkiger Kreide; so ist sie nicht in Salzsäure löslich (siehe Experimente, V 5 F). Sie zeigt an leicht abgeschliffener Oberfläche oftmals einen bläulichen Glanz, der an den wasserreichen Opal oder an Chalcedon erinnert. |
Hinweis zu weiteren Informationen
Über die Eigenschaften des Feuersteins, seine Bildung, seine Zusammensetzung, seine Alterung,
die Schälbarkeit sowie über seine alte und seine moderne technische Verwendung können Sie sich auf
weiteren Webseiten informieren. Außerdem besprechen wir, wie man mit Flint Feuer machen kann. Gehen
Sie dazu in das Inhaltsverzeichnis der Webseitengruppe "Pyrit
und Feuerstein/Flint/Silex".
Weitere Texte zum Thema „Pyrit und Feuerstein“