Trennung von Wasser und Ethanol - ein schwieriges Unterfangen
Experimente:
Versuch: Siedepunkte von Wasser und Ethanol
Versuch: Trennung von Ethanol und Wasser durch Aussalzen
Die Siedepunkte von Wasser (100 °C) und Alkohol (78,3 °C) liegen relativ nahe beieinander
(-> Versuch). Dennoch sollte es keine Schwierigkeiten bereiten, sie
durch Destillation ("Brennen") zu trennen.
Jedoch reißt der siedende Alkohol ab einer Konzentration von 96,5 Vol% auch Wasserdampf mit. Man kann auf diese Weise niemals einen 100%igen, wasserfreien Alkohol erhalten. Auch durch wiederholtes Destillieren lassen sich nur geringfügig höhere Alkoholkonzentrationen erreichen. Schlecht trennbare Gemische reinigt man gern mit einer Kolonne, also mit einer vielfach wiederholenden Destillation unter einem Temperaturgradienten. Auch das bringt hier nichts.
Der Grund liegt woanders: Wasser und Ethanol bilden ein azeotropes Gemisch: Ethanol 96,5 Vol% und Wasser 3,5 Vol%. Dieses Gemisch kann durch Destillation nicht weiter voneinander getrennt werden. Es hat mit 78,15 °C einen gemeinsamen Siedepunkt, der niedriger liegt als die Siedepunkte der Einzelkomponenten.
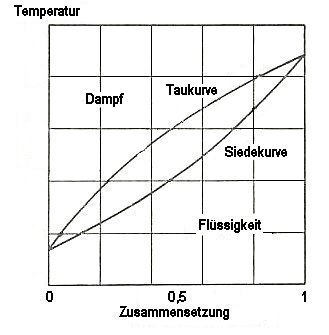
Um das zu verstehen, müssen wir uns die Siedediagramme von Gemischen anschauen. Siedediagramme zeigen eine Kondensations- oder Taukurve und eine Siedekurve. Um Gemische in die reinen Komponenten zu trennen, müssen sich die siedende Flüssigkeit und der bei der Temperatur zugehörige Dampf in ihrer Zusammensetzung unterscheiden. So reichert sich im Dampf stets die Substanz mit dem niedrigeren Siedepunkt an, so dass ihre Konzentration im Dampf höher ist als in der Flüssigkeit. Die beiden Zusammensetzungen zeigt eine waagerechte Linie, die Tau- und Siedekurve miteinander verbinden. Wenn man den Dampf abtrennt und abkühlt, so hat man die flüchtigere Komponente angereichert.

Bild 1: Siedediagramm eines destillativ trennbaren Gemischs
Beim azeotropen Punkt jedoch berühren sich Tau- und Siedekurve. Sie bilden ein Maximum
(bei anderen Gemischen ist auch ein Minimum möglich). Das Gemisch kann destillativ nicht mehr getrennt
werden.
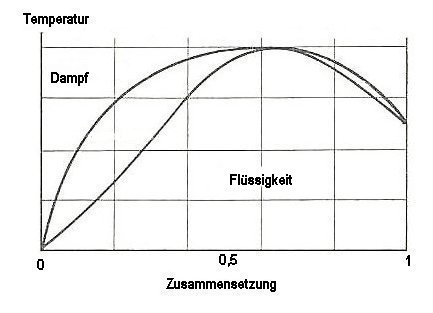
Bild 2: Siedediagramm eines Gemischs mit azeotropem Punkt
Das Aussalzen von Alkohol
Eine beliebte Methode der Chemie zur Stofftrennung ist das "Aussalzen". Hierbei gibt man zu einem
Gemisch eine Portion eines festen, inerten Salzes. Beispiele sind Natriumsulfat (Glaubersalz), Natriumchlorid,
Kaliumnitrat oder Kaliumcarbonat. Es handelt sich um einen physikalischen Effekt: Diese Salze konkurrieren
mit dem Alkohol um das Wasser und verringern so seine Löslichkeit (-> Versuch).
Zur Erklärung siehe auch diese Webseite.
Wie man absoluten Alkohol herstellt
Für viele chemische Zwecke benötigt man absoluten, also 100%igen Alkohol. Beispiele
sind Synthesen wie Veresterungen ohne Schwefelsäure oder spektroskopische Untersuchungen, bei denen reinstes
Ethanol als Lösemittel dient.
Will man absoluten Alkohol aus wasserhaltigem "Bioalkohol" herstellen, so muss man wasseranziehende (hygroskopische) Stoffe hinzugeben. Beispiele sind Calciumoxid oder wasserfreies Calciumchlorid.
Zur Entwässerung werden auch Molekularsiebe genutzt. Der Begriff "Sieb" ist irreführend, denn Molekularsiebe halten kleine Moleküle (Wasser) zurück und lassen die großen (Ethanol) durch. Meistens handelt es sich um Kieselgel oder Zeolithe. Der Alkohol wird über dem Kieselgel stehengelassen, oder man filtriert das Kieselgel samt adsorbiertem Wasser ab.
Man kann aber Benzol oder Toluol zugeben und erhitzen. Es destilliert ein so genanntes ternäres Gemisch aus Wasser, Benzol und Ethanol ab. Auf diese Weise lässt sich zwar das Wasser entfernen; man muss sich vorher aber überlegen, ob nicht der aromatische Kohlenwasserstoff stören könnte.
Wenn gar nichts anderes hilft, muss man synthetischen Alkohol nehmen.
Weitere Texte zum Thema „Alkohol“