Reaktionen 1. Ordnung
Im anderen Beispiel zerfällt der Stoff einfach, ohne dass es dazu einen Anlass gäbe. Dieser Reaktionstyp ist mit dem radioaktiven Zerfall zu vergleichen. Wir wissen, dass soundsoviele Teilchen einer gegebenen Menge zerfallen werden. Welches der Moleküle aber zerfällt, können wir nicht voraussagen. Bei diesem Reaktionstyp hängt die Reaktionsgeschwindigkeit von der jeweiligen Konzentration ab: Ist viel Stoff da, reagiert auch viel ab und es bildet sich viel Produkt. Wir sprechen von einer Reaktion 1. Ordnung.
Diese ist für schulgemäße Untersuchungen wunderbar geeignet, um das Bewusstsein für das Quantitative in der Chemie zu schärfen. Ihre Auswertung macht Schülern erfahrungsgemäß viel Spaß. Vor allem gibt es viel zu zeichnen, und die vielen Rechnungen bewältigt der Computer ohne Probleme.
Verfolgen wir den zeitlichen Verlauf der Konzentrationen der an Reaktionen 1. Ordnung beteiligten Stoffe. Wir erhalten Exponential-Kurven. Bei Verschwinden eines Stoffes resultiert eine Abklingkurve, im Falle der Bildung eine spiegelbildliche Sättigungskurve.
Die Reaktionsgeschwindigkeit ist für diesen Reaktionstyp:
dcA / dt = - k · cA mol/l sec-1
Für das Entstehen der beiden Stoffe C und D gilt der positive Ansatz:
dcB / dt = + k · cA mol/l sec-1
Um die Konzentrations/Zeitgesetze zu erhalten, muss man diese Gleichungen integrieren.
Das Konzentrations/Zeitgesetz lautet für den Abbau eines Stoffs A:
cA = cA0 · e -k . t
cA = Konzentration zur Zeit t
cA0 = Anfangskonzentration
Die Bildung des Produkts B beschreibt die folgende Gleichung.
cB = cA0 · (1 - e -k . t)

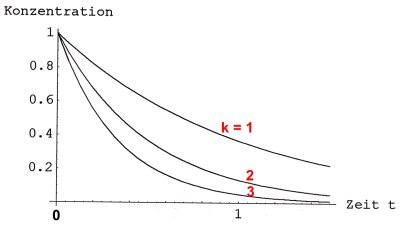
Reaktionen 1. Ordnung mit verschiedenen Werten von k
Man erkennt deutlich: Die Reaktionsgeschwindigkeit (das ist die Steigung der
Tangente an die Kurven) ist zu Beginn der Reaktion am größten. Warum wird sie im
Verlauf der Reaktion immer kleiner? Gründe sind: Weil Reaktionspartner immer
seltener werden, wird die Trefferwahrscheinlichkeit zunehmend geringer, das System
wird diffusionsbestimmt. Außerdem greifen Nebenreaktionen, zu denen auch
Rückreaktionen gehören.
Hier wird deutlich, dass chemische Reaktionen nicht schlagartig ablaufen, sondern "Abklingereignisse" sind. Ein Vergleich mit anderen Abläufen verdeutlicht das: Exponentielle Abklingkurven treten auf bei der Entladung eines Kondensators, beim radioaktiven Zerfall, bei der Dämpfung der Schwingung einer Geigensaite und beim Nachhallen eines Musiktons. Die gleichen Überlegungen gelten auch, wenn man anstelle der Zeit die Zahl der Reinigungsschritte eines Mediums als Parameter wählt, die notwendig sind, um einen Schadstoff aus einem belasteten Medium beispielsweise durch mehrfache Extraktionen zu entfernen. Auch die Ausspülung eines Medikaments durch den Harn erfolgt nach den Gesetzen einer e-Funktion.
Bei Reaktionen 1. Ordnung ist die Halbwertszeit umgekehrt proportional zur Geschwindigkeitskonstanten:
t½ = ln 2 / k (Zeiteinheit)
Je größer die Konstante ist, desto kleiner ist die Halbwertszeit. Am besten merkt man sich diesen Ausdruck:
t½ · k = ln 2
Halbwertszeiten sind am bekanntesten im Zusammenhang mit dem radioaktiven
Zerfall von Isotopen. Die Halbwertszeit von Radon-209 beträgt 30 min, von
Strontium-90 28,1 Jahre, von Plutonium-239 24.400 Jahre und von Kalium-40 1,28 ·
109 Jahre. (Radon wird von gewissen Baustoffen oder Böden emittiert (Wismut-AG).
Strontium entsteht als Produkt der Kernspaltung. Plutonium wird künstlich im Brüter
aus Uran gewonnen und dient als Reaktorbrennstoff oder zur Herstellung von
Nuklearwaffen. Kalium wird aus Kohlekraftwerken emittiert und wandelt sich in das
Edelgas Argon um.)
Man entnimmt diesen Zahlen übrigens auch, dass das giftigste Dioxin, das Seveso-Gift
TCDD, fünfmal stabiler ist als etwa Strontium-90.
Von großem Interesse ist, wann eine Reaktion 1. Ordnung auf 1/1000 der Anfangskonzentration abgeklungen ist.
Bemerkenswert ist auch die Zeit, bei der c = c0/e ist. Da e = 2,718 ist, gilt etwa c = c0/3. Hier gilt
t1/e · k = 1
Der Kehrwert des zugehörigen Zeitwerts t1/e ist also gleich dem Wert der Geschwindigkeitskonstanten.
Weitere Texte zum Thema „Reaktionskinetik“