Das Lambert-Beersche Gesetz
Experimente:
Versuch: Lambert-Beersches-Gesetz

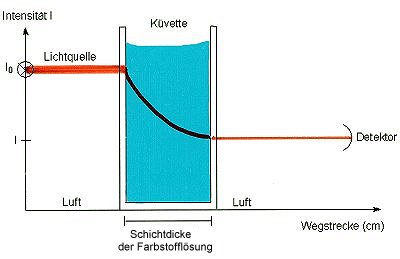
Wenn Licht durch ein farbiges Medium wandert, wird es absorbiert. Die Abnahme der Intensität I des Lichts längs der Schichtdicke d wird interessanterweise durch eine Abklingfunktion beschrieben, wie wir sie auch bei Reaktionen 1. Ordnung kennengelernt haben.
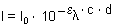
Den absoluten Potenzterm nennen wir Extinktion E oder auch Absorption A.
El = el · c · d
(Extinktion, lat. extenuo, schwächen.)
Dieser Ausdruck ist bereits das Lambert-Beersche Gesetz.
In der Gleichung bedeuten
El dimensionslose Extinktion oder Absorption bei einer bestimmten Wellenlänge
l
el molarer Extinktionskoeffizient (cm2/mol)
c Konzentration des Stoffs (mol/cm3)
d Schichtdicke der Messküvette (cm).
Man erhält das Gesetz auch durch Logarithmieren der Abklingfunktion. Damit wird deutlich, dass die Extinktion nichts anderes als das logarithmierte Verhältnis von Anfangsintensität I0 zur nach dem Durchgang durch die Probe mit der Schichtdicke d gemessenen Intensität I ist. Das muss während der Messung einkalkuliert werden. Mit Hilfe der Beziehung
I = I0 · 10-E
berechnen wir die folgende Tabelle.
Extinktion
Absorbiertes Licht (%)
Nicht absorbiertes Licht (%)
E = 0
0
100
E = 0,1
20,6
79,4
E = 0,5
68,4
31,6
E = 0,9
87,5
12,5
E = 1
90
10
E = 2
99
1
E = 3
99,9
0,1
Bei Extinktionen über 2 machen sich bereits messtechnische Probleme bemerkbar; deshalb sind auch die Skalen an den Messgeräten hier nicht mehr genau ablesbar.
Das Gesetz von Lambert-Beer besagt, dass die Absorption von elektromagnetischer Strahlung proportional zur Konzentration des absorbierenden Stoffs ist. Es gilt streng nur für sichtbares Licht und UV-Strahlung.
Der molare Extinktionskoeffizient ist eine spezifische Stoffkonstante; er hängt dazu noch von der Wellenlänge ab, da ein gegebener Stoff über den ganzen Wellenlängenbereich hinweg unterschiedlich absorbiert, d. h. er zeigt ein Spektrum. Das zeigt die folgende Abbildung.
| Klick mich an! |
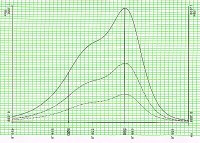 |
| Spektren von Kristallviolett bei verschiedenen Konzentrationen |
Das Gesetz kann man ausgezeichnet mit dem Triphenylmethanfarbstoff Kristallviolett
(KV) bestätigen (-> Versuch).
Man benutzt das Lambert-Beersche-Gesetz, um Konzentrationen zu bestimmen. Es
gibt dazu zwei Möglichkeiten.
Zunächst jedoch erstellt man in beiden Fällen eine Eichkurve, indem man bei einer
ausgewählten Wellenlänge die Extinktionen bei verschiedenen Konzentrationen misst
und gegeneinander aufträgt. Damit überprüft man überhaupt die Gültigkeit des
Gesetzes. Denn man muss eine Gerade bekommen. Manchmal kann es zu
Wechselwirkungen mit dem Lösemittel kommen, dann weicht die Gerade
kontinuierlich ab. Liegen die Messpunkte in dem Diagramm stark ("statistisch")
zerstreut oder weicht ein Messpunkt stark aus, so hat man Fehler bei der Messung
gemacht. Beispiele sind beschmutzte Küvetten, Luftblasenbildung in der Lösung,
falsche Verdünnungsmaßnahmen oder fehlerhafte Konzentrationsberechnungen.
| Klick mich an! |
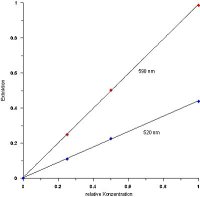 |
| Eichgerade nach Lambert-Beer für Kristallviolett |
Man kann nun bei weiteren Extinktionsmessungen anhand dieser Gerade die
zugehörigen Konzentrationswerte graphisch ablesen.
Man kann aus der Steigung aber auch den Extinktionskoeffizienten ermitteln und
diesen dann dazu benutzen, um nach Umstellung des Lambert-Beerschen Gesetzes
aus einem Extinktionswert die zugehörige Konzentration zu berechnen. Dabei tritt
aber die Schwierigkeit auf, dass man die Terme der Gleichung in unterschiedlichen
Dimensionen vorliegen hat!
Ein Beispiel
Man hat für die Extinktion den Wert 1 gemessen. Der Extinktionskoeffizient sei 104
cm2/mol, die Schichtdicke der Küvette ist 1 cm.
c = El / (el · d)
c = 1 / (104 cm2 / mol · 1 cm)
c = 10-4 mol / cm3
Zur Umrechnung in mol/l müssen wir mit dem Faktor 1000 multiplizieren:
c = 10-1 mol / l
Weitere Texte zum Thema „Reaktionskinetik“