Reaktionskinetische Analyse der Urease-Reaktion
Experimente:
Versuch: Reaktionsspezifität der Urease
Gleich vorneweg ein Hinweis: Dies ist eine Anleitung, die zwar für die Schule oder
einfache Ausbildungsstätten geeignet ist, jedoch nur begrenzt für die Lehre an Universitäten
eingesetzt werden kann.
Zunächst sollte man das Enzym anhand qualitativer oder halbquantitativer Versuche vorstellen.
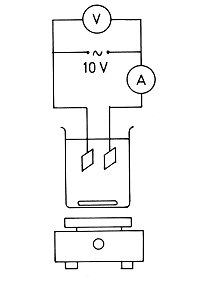
Zur quantitativen Analyse nach Michaelis-Menten benötigen wir die Reaktionsgeschwindigkeit (genau genommen: die Anfangsgeschwindigkeit v0 der Enzymreaktion) in Abhängigkeit von der Substratkonzentration. Zur Messung nutzen wir die Änderung der elektrischen Leitfähigkeit einer Harnstofflösung aus (Konduktometrisches Messverfahren). Lösungen von Harnstoff selbst leiten den elektrischen Strom nicht, wohl aber die der Reaktionsprodukte (NH4+-, HCO3-- und OH--Ionen). Man kann sich eine Apparatur zur Messung von Leitfähigkeiten im Bereich um 104 Siemens selbst zusammenstellen (Siemens steht für V · A-1 oder reziproke Ohm (= mho)). Man benötigt dazu eine Wechselstromquelle für eine Spannung von etwa 10 Volt und ein Amperemeter (Messbereich 3 bis 30 mA).

Messapparatur zur Konduktometrie
Besser geeignet sind jedoch käufliche Konduktometer, da diese die Leitfähigkeiten mit
hochfrequentem Wechselstrom zu messen gestatten.
Als Elektroden nehmen wir blanke Platinblechelektroden. Es ist wichtig, dass
deren Abstand stets gleich bleibt. Der Messbereich hängt von Abstand, Größe und
Oberflächenbeschaffenheit ab. Deshalb ist es gut, wenn man vorgefertigte
Leitfähigkeitsmesszellen nimmt. Eine Ermittlung der Zellkonstanten ist für die Messung
nicht notwendig!
Noch ein Hinweis: Platinierte Elektroden sind empfindlich gegen Proteine. Sie
können jedoch mit Natriumdodecylsulfonat gereinigt werden, das in Feinwaschmitteln
wie FEWA enthalten ist. Man kann sich daher dieser Waschmittel bedienen. Vor
und zwischen den Versuchen sind die Elektroden gut abzuspülen.
Die Lösungen sollten in sauberen Bechergläsern hergestellt werden, die möglichst identisch
sind, auch in Bezug auf die Glasqualität. Sie werden vor den Versuchen einige Tage in destilliertem
Wasser gewässert, um zu große Leitfähigkeitsunterschiede der Harnstofflösungen zu
vermeiden. Auf diese Weise reicht für die Aufnahme der Kinetik erfahrungsgemäß ein
Messbereich am Konduktometer aus.
Lösungen zur Ureasekinetik
A Harnstofflösungen
Man löst 1 g Harnstoff in 1 l destilliertem Wasser.
Daraus stellt man Verdünnungen her und berechnet die Substratkonzentration [S]:
| ml Harnstofflösung | ml dest. Wasser | [S] g / l |
| 10 10 10 10 10 10 10 |
10 20 30 40 50 60 70 |
1/2 1/3 1/4 1/5 1/6 1/7 1/8 |
B Ureasesuspension
Man gibt 10 mg Urease (zum Beispiel von Merck) in 10 ml destilliertes Wasser und
schüttelt gut um. Zum Pipettieren lohnt sich der Einsatz eines kleinen Rührwerks.
Ablauf der Messungen
a Vormessung zur Bestimmung der Eigenleitfähigkeit der Ureaselösung
10 ml von demjenigen destillierten Wasser, das als Lösungsmittel für Harnstoff dient, werden in ein
Messgefäß gegeben. Der Eigenleitwert des Wassers (LH2O) wird gemessen und notiert. Nun gibt
man 1 ml der gerührten Ureasesuspension zu und misst erneut. Die Differenz der beiden Messungen ist der
Eigenleitwert der Urease (LUrease). Während der Messung muss gerührt werden.
b Messungen der Ureasekinetik
10 ml Harnstofflösung werden in das Messgefäß gegeben; der Leitwert der Lösung (LLösg)
wird gemessen und notiert. Mit der Zugabe von 1 ml der gerührten Ureasesuspension
setzt man die Stoppuhr in Gang. Man misst nach 2 Minuten den Leitwert L120.
(Der Leitwert ist der Kehrwert des gemessenen Widerstands.)
Berechnung der Reaktionsgeschwindigkeit
Als (wenn auch etwas grobes) Maß für die Anfangsgeschwindigkeit v0 der Enzymreaktion
wird die folgende Differenz gewählt:
DL120 = L120 - ( LLösg + LH2O + LUrease)
Bestimmung des KM -Wertes der Urease
Man trägt in einem Diagramm 1 / DL120 gegen 1 / [S]
auf:
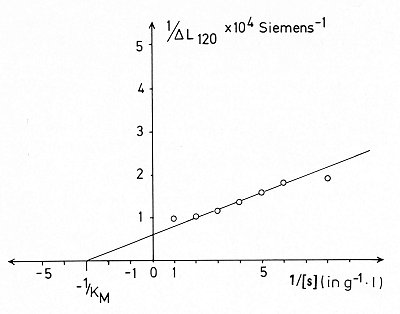
Kinetik der Urease. Auftragung nach Lineweaver-Burk
Aus dem Abszissenabschnitt wird 1 / KM = 3,0 l / g abgelesen;
daraus folgt KM = 0,33 g Harnstoff / l oder 5,6 ·
10-3 mol / l.
(Der Vergleichswert der Literatur ist 0,63 g / l beziehungsweise 1,05 ·
10-2 mol / l.)
Quelle:
nach: R. Blume und H. Wenck: Enzymatisch aktive Proteine. In: Der Chemieunterricht CU
11 (1980), Heft 4.
Weitere Texte zum Thema „Reaktionskinetik“