Folgereaktionen mit vorgelagertem Gleichgewicht:
Die Michaelis-Menten-Gleichung für Enzymreaktionen
Experimente:
Versuch: Alkoholtest mit der Alkohol-Dehydrogenase (ADH)
Versuch: Reaktionskinetische Analyse der Urease-Reaktion
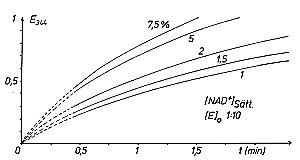
Wenn man Kinetiken von Enzymreaktionen aufnimmt, so erhält man primär die für
reaktionskinetische Messungen bekannten Abkling- oder Sättigungskurven (->
Versuch) im c / t -Diagramm (Bild 1). Statt der
Konzentration c kann man auch direkt zu c proportionale Größen
wie die Absorption von VIS- bzw. UV-Strahlung (Extinktion) oder (im Falle von
Leitfähigkeitsmessungen) den Leitwert auftragen (-> Versuch).

Bild 1: Eine Serie von Einzelmessungen zur Ermittlung der Anfangsgeschwindigkeit
bei Enzym-Substrat-Reaktionen; Extinktions-Zeit-Kurven der ADH-Reaktion;
Parameter ist die relative Substratkonzentration (Ethanol) [1]
Diese Messungen auszuwerten ist sehr schwierig, weil sich während der Aufnahme
der Messkurven die Reaktionsordnung ändert. Es erwies sich als praktikabel, die
Anfangsgeschwindigkeit v0 zu ermitteln und deren Abhängigkeit von der
Substratkonzentration zu untersuchen. Erstere ist gleich der Steigung der c / t -Kurve
im Startpunkt der Reaktion, also bei t = 0. Grund: Die Reaktion verläuft zu Beginn
nicht nur am schnellsten, sondern ist auch noch unbeeinflusst von Rückreaktionen,
Hemmung durch Produkte, Folge- und Nebenreaktionen (usw.).
Trägt man diese Anfangsgeschwindigkeit gegen die zugehörige Substratkonzentration
auf, so erhält man gebogene Sättigungskurven wie in Bild 2.
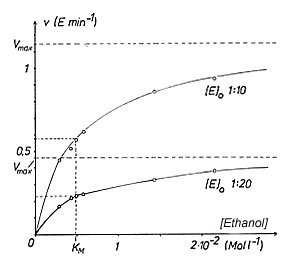
Bild 2: Geschwindigkeits/Substratkonzentrations-Diagramm einer Enzymreaktion;
Beispiel ADH mit zwei Enzymkonzentrationen [1]
Die Annahmen
Mit diesem Verhalten befassten sich L. Michaelis und
M. Menten.
Hier sind ihre Überlegungen:
Die Sättigungskurven lassen sich dadurch erklären, dass das Enzym E sich mit
seinem Substrat S zu einem Enzymsubstrat-Komplex ES verbindet. Es stellt sich ein
schnelles Bildungsgleichgewicht ein. Dieser Komplex reagiert in einer
langsamen Reaktion unter Rückbildung des Enzyms zum Produkt P. Damit ist die
Produktbildung bestimmend für die Gesamtgeschwindigkeit (-> Folgereaktionen).
Es ist eine Maximalgeschwindigkeit zu erwarten; dieser Sättigungszustand ist dann erreicht, wenn
alle Bindungsstellen des Enzyms mit Substrat belegt sind. Sie ist also eine Frage der
Substratkonzentration.
Briggs-Haldane erweitern den Ansatz von Michaelis-Menten
Michaelis und Menten nahmen an, dass die Geschwindigkeit der Produktbildung
vernachlässigbar klein ist und deshalb ihre Konstante nur als eine
Komplexbildungskonstante ("Substratkonstante Ks") formulierten. Wir gehen jedoch
vom erweiterten Ansatz nach G. E. Briggs und J. B. S. Haldane (1925) aus und
berücksichtigen in unseren Rechnungen auch die Geschwindigkeitskonstante der
Produktbildung.
Die Herleitung der Michaelis-Menten-Gleichung
Die Ausgangslage ist also eine Reaktionskette mit vorgelagertem schnellem
reversiblen Gleichgewicht. Da einer der Stoffe Katalysator ist, bildet er sich zurück.
Statt einer Reaktionskette haben wir einen Katalysereaktionszyklus.
Zur Herleitung der Michaelis-Menten-Gleichung gehen wir aus Praktikabilitätsgründen von der linear formulierten Reaktionskette aus:
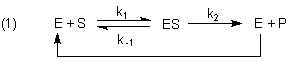
In den folgenden Gleichungen bedeuten
| [E] | = | Konzentration des Enzyms zum betreffenden Zeitpunkt |
| [E]0 | = | Gesamtkonzentration des Enzyms |
| [ES] | = | Konzentration des Enzymsubstratkomplexes zum betreffenden Zeitpunkt |
| [S] | = | Substratkonzentration zum betreffenden Zeitpunkt |
Die Bildungsgeschwindigkeit von ES ist die einer Reaktion 2. Ordnung
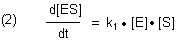
Außerdem wird ES durch zwei Reaktionen 1. Ordnung abgebaut, einmal durch die Rückreaktion im Sinne eines Komplexzerfalls und weiter durch die Produktbildung.
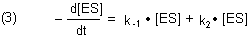
Im Gleichgewichtszustand ("Steady State") sind die beiden Geschwindigkeiten gleich:
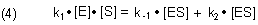
Die folgenden Rechnungen zielen darauf, die unbekannten Konzentrationen von ES und E in den Gleichungen zu isolieren, um sie zu Gunsten messbarer Größen zu eliminieren.
Wir fassen die rechte Seite in Gl. (4) zusammen, teilen durch k1 und bekommen einen Ausdruck, in dem alle Geschwindigkeitskonstanten in einem Term zusammengefasst sind.
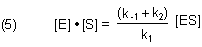
Der Konstanten-Term in (5) ist die berühmte Michaelis-Konstante KM in der Form von Briggs-Haldane.
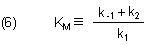
(Merkhilfe: Im Nenner steht die Geschwindigkeitskonstante der ES-Bildungsreaktion. Der Zähler ist die Summe der Konstanten der beiden ES-Zerfallsreaktionen.)
Man erkennt, dass KM keine Gleichgewichtskonstante im Sinne einer Komplexbildung ist, sondern eine echte kinetische Konstante. Man kann sie zur Verdeutlichung "auseinandernehmen".
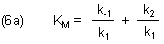
Hierbei ist der Quotient k-1 / k1 eine Gleichgewichtskonstante, die die Dissoziation eines Komplexes beschreibt. Michaelis und Menten nannten sie Substratkonstante Ks.
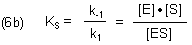
Der Term k2 / k1 beschreibt dagegen als kinetische Konstante eine lineare Folgereaktion des Typs A -> B -> C. Ist k2 sehr klein im Vergleich zu k-1, so haben wir den Michaelis-Menten-Fall mit KM = Ks.
(5) und (6) ergeben zusammen
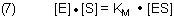
[ES] ist unbekannt. Mit der für die Kinetik üblichen stöchiometrischen Randbedingung [E]0 = [E] + [ES] folgt aus (7)
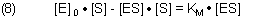
Wir lösen die Gleichung nach [ES] auf.
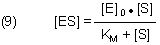
Die ebenfalls unbekannte Konzentration von E können wir durch folgende
Überlegung eliminieren:
Die Geschwindigkeit der Gesamtreaktion, also die Produktbildung, hängt vom
Zerfall von ES in Richtung auf die Produktbildung ab. Das Gesetz gilt nur, wenn es
sich bei der Geschwindigkeit um die von Michaelis und Menten eingeführte
Anfangsgeschwindigkeit v0
der Enzymreaktion handelt.
(10) v0 = k2 · [ES] ; daraus folgt: [ES] = v0 / k2
Wir setzen ES aus (10) in (9) ein und erhalten nach Umformung
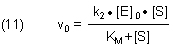
Der Ausdruck k2 · [E]0 ist die Maximalgeschwindigkeit Vmax, d. h. diejenige Geschwindigkeit, die man erhält, wenn die gesamte Enzymmenge in der Form ES vorliegt. Das ist die Geschwindigkeit, bei der das Enzym unter Bedingungen der Vollsättigung arbeitet. Hier ist das Bildungsgleichgewicht des ES-Komplexes vollständig auf die Seite ES verschoben; [ES] = [E]0. Nach dem Zerfall von ES zu E + P wird das freiwerdende aktive Zentrum augenblicklich wieder von Substratmolekülen besetzt. Dies wirkt sich aus, dass Produkt gebildet wird, ohne dass die Konzentration des Substrats merklich abnimmt. Man kennt dies von Reaktionen Nullter Ordnung, die auch von der heterogenen Katalyse her bekannt sind.
Mit (11) erhalten wir die endgültige Michaelis-Menten-Gleichung.
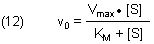
(Mathematisch betrachtet ist die Michaelis-Menten-Gleichung eine verschobene, rechtwinklige Hyperbel. Siehe hierzu unsere Webseite.) Wir erkennen anhand der Gleichung (12), dass die Michaelis-Konstante die Dimension einer Konzentration besitzt.
Bestimmung der Michaelis-Konstante
Die Michaelis-Konstante erhält man, wenn man in Gl (12) v0 =
Vmax / 2 setzt. Dann
folgt
(13) [S]halbsätt = KM
Vergleiche hierzu Bild 2.
Die Michaelis-Konstante ist die Substratkonzentration bei Halbsättigung des Enzyms.
Aus einer gebogenen Kurve, die zudem häufig genug nicht zu Ende gemessen werden kann, ist es schwierig, die Halbsättigung zu ermitteln. Deshalb gab es schon früh Versuche, die Kurve zu linearisieren. Eine Methode ist die nach Lineweaver-Burk.
Zum Schluß ein Hinweis
Anfänger verwechseln die Kurve im Michaelis-Menten-Diagramm häufig mit der c /
t -Sättigungskurve, die man zum Beispiel bei den Produkt-Kurven bei Reaktionen 1.
Ordnung erhält. Man muss deshalb unbedingt darauf hinweisen, dass es sich beim Michaelis-Menten-Diagramm
um ein aus c / t -Kurven hergeleitetes Sekundär-Diagramm handelt.
Literatur
[1] R. Blume, Quantitative Enzymkinetik: Die Alkoholdehydrogenase (ADH); 1. Charakteristik,
kinetische Analyse und Substratspezifität; Praxis der Naturw. (Biologie) 27 (1978), 65-78.
Weitere Texte zum Thema „Reaktionskinetik“