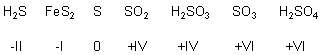
Die Oxidationszahlen des Schwefels
Bei Redoxreaktionen werden Elektronen übertragen. Dabei ist die Zahl der Elektronen nicht beliebig. Man spricht in diesem Zusammenhang von Wertigkeit und sagt z. B., dass Magnesium (wie der Sauerstoff) zweiwertig ist. Die Ladung der Ionen ist gleich ihrer Wertigkeit. Magnesiumoxid MgO besteht aus Mg2+-Ionen und O2--Ionen.
Was ist aber, wenn (wie bei den Schwefelverbindungen) als Produkt einer Redoxreaktion gar keine Ionen vorliegen? Beispielsweise werden bei der Bildung von Schwefeldioxid aus den Elementen zwei Bindungen mit je zwei Elektronen geknüpft. Diese vier Elektronen stammen vom Schwefel. Aber der liegt nicht als positiv geladenes Ion vor. SO2 ist eine Molekülsubstanz.
Offenbar ist aber auch beim Verbrennen von Schwefel eine Redoxreaktion abgelaufen. Schwefelatome haben Elektronen auf Sauerstoffatome übertragen. Nun tut man einfach so, als ob sich Ionen gebildet hätten und berechnet eine formale Oxidationszahl. Sie ist keine echte Ladungszahl, sondern gibt nur die Zahl der an den Bindungen eines Elements beteiligten Elektronen an. Ihr Vorzeichen beschreibt die Richtung der Elektronenübertragung.
Die Oxidationszahl von Metallen hat stets ein positives Vorzeichen. Bei den Nichtmetallen ist das anders, wie wir gleich bei den Verbindungen des Schwefels sehen werden: Die Ordnungszahl des Elements mit höherer Elektronegativität bekommt ein negatives, die des anderen Elements ein positives Vorzeichen.
Zur Abgrenzung gegen die Anzahl der elektrischen Ladungen von Ionen wird die Oxidationszahl mit römischen Ziffern geschrieben; das Vorzeichen steht vor der Ziffer. Die Zahl steht über dem chemischen Symbol des betreffenden Elements.
Zur Berechnung der Oxidationszahlen gilt als einfachste Regel:
Wasserstoff hat die Oxidationszahl +I, Sauerstoff -II.
Von diesen Werten ausgehend lassen sich bei gegebener Verbindung die meisten Oxidationszahlen der anderen Elemente berechnen.
Die Summe aller Oxidationszahlen in einer Formeleinheit muss gleich Null sein.
Hier sind Beispiele zur Berechnung der Oxidationszahlen.
Magnesiumoxid hat die Formel MgO. Da Sauerstoff zwei Elektronen aufnimmt (Oxidationszahl
-II), muss Magnesium zwei abgegeben haben (Oxidationszahl +II).
Im Chlorwasserstoff (HCl) hat Chlor die Oxidationszahl -I, da Wasserstoff die Oxidationszahl +I hat.
Wie groß ist die Oxidationszahl des Schwefels in der Schwefelsäure? Da die Summe der Oxidationszahlen aller Atomarten in einer Verbindung gleich Null sein muss, muss die von Schwefel +VI sein:
H2SO4: 2 · (+I) + 4 · (-II) = -VI, also S (+VI)
Die Oxidationszahlen der wichtigsten Verbindungen des Schwefels:
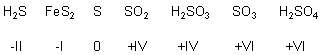
Im Schwefelwasserstoff und im Pyrit liegt das Element Schwefel reduziert vor, in den anderen Verbindungen ist es oxidiert. Je mehr Sauerstoff in den Oxiden gebunden wird, desto höher ist natürlich auch die Oxidationszahl des oxidierten Elements.
Weitere Texte zum Thema „Schwefel“