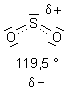
Die Molekülstruktur von Schwefeldioxid
Am Schwefelatom ist ein freies, nichtbindendes Elektronenpaar vorhanden. Mit zwei Liganden muss das SO2-Molekül schon aus Gründen der Abstoßung der Elektronenpaare gewinkelt sein.

Es ist tatsächlich von trigonaler, flächiger Symmetrie. Der O-S-O-Bindungswinkel beträgt ungefähr 120 °, also 360/3 °. Das spricht für ein sp2-Hybrid-System wie beim Ethen.
Die Leser werden hier den Hinweis auf die Nichtgültigkeit der Oktettregel für die höheren Schwefelverbindungen vermissen. Diese Regel gilt immer noch. Die Theorie der Oktettaufweitung, die man lange Zeit benutzt hat, um die Strukturen zu erklären, ist mittlerweile überholt.
Folgende mesomere Grenzstrukturen sind denkbar.
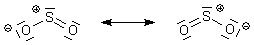
Es gibt eine wenn auch schwache Verschiebung der Elektronen in Richtung auf den Sauerstoff, so dass das Molekül ein (wenn auch schwacher) permanenter Dipol ist. Aus diesem Grunde kann SO2 (anders als etwa CO2) schon bei relativ hohen Temperaturen verflüssigt werden oder "gefrieren".
| FP °C | SP °C | |
| SO2 | -75,48 | -10,02 |
Bei der Diskussion der SO2-Struktur liegt wieder ein Vergleich mit dem Sauerstoff nahe. Die Vergleichssubstanz ist Ozon O3. Auch dieses Molekül ist gewinkelt (O-O-O-Winkel 116,8 °).
Weitere Texte zum Thema „Schwefel“