Die Molekülstruktur der Schwefelsäure und der Sulfat-Ionen

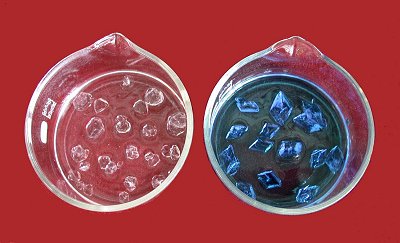
Sulfate von Aluminium und Kupfer (Foto: Daggi)
Beim Sulfat-Ion sind alle S-O-Bindungen gleichwertig und haben z. B. die gleichen Bindungslängen.
Ausgangsverbindung für die Schwefelsäure bzw. das Sulfat-Ion ist letztlich das Anhydrid SO3. Diese Lewissäure kann Lewis-Basen wie das O2--Ion oder ein H2O-Molekül addieren. Auf diese Weise entsteht das bekannte Sulfat-Ion.
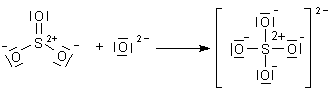
Das Sulfat-Ion ist tetraedrisch aufgebaut. Das s-Bindungsgerüst eines Tetraeders ergibt sich schon aus der Möglichkeit der sp3-Hybridisierung der 3s- und der drei 3p-Orbitale. Das können wir mit den s-Bindungen des Kohlenstoffs im Methan vergleichen.
Die Leser werden hier den Hinweis auf die Nichtgültigkeit der Oktettregel für die höheren Schwefelverbindungen vermissen. Diese Regel gilt immer noch. Die Theorie der Oktettaufweitung, die man lange Zeit benutzt hat, um die Strukturen zu erklären, ist mittlerweile überholt. Grund sind die großen Energieunterschiede zwischen den 3p- und 3d-Orbitalen, so dass keine Hybridisierung möglich ist.
Analoges gilt übrigens auch für die sauerstoffreichen Säuren des Siliciums (H4SiO4), des Phosphors (H3PO4; -> Frage 1135) sowie des Chlors (HClO4).
Weitere Texte zum Thema „Schwefel“