Prof. Blumes Tipp des Monats Februar 2010 (Tipp-Nr. 152)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Zahlenspielereien um das Wasserstoffatom
Man findet, wenn es um atomare Dimensionen geht, immer wieder erstaunliche Aussagen, die zum Nachdenken anregen. Beispiele:
|
- Der Radius des Atomkerns verhält sich zu dem der Atomhülle wie der Radius eines Tennisballs zur Höhe des Kölner Doms - Materie ist eigentlich leerer Raum (wie es der Streuversuch von Rutherford deutlich macht…) - Die Dichte des Atomkerns beträgt ca. 100 Millionen Tonnen pro Kubikzentimeter |
Kann man das alles irgendwie wenigstens annähernd berechnen?
Wir können. Dazu brauchen wir nur drei Daten:

Die Rechnungen sind relativ einfach. Wir müssen nur mit den Dimensionen aufpassen. Sonst vertut man
sich kräftig mit den Zehnerpotenzen…
1. Das Verhältnis der Radien von Atomkern und Atom
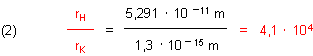
Das Radienverhältnis beträgt etwa 1:40.000.
Zum Vergleich denken wir uns einen Kreis mit einem Radius, der der Höhe des Eiffelturms gleicht (324 m). Im Zentrum des Kreises liegt eine kleine Murmel mit dem Radius von 0,8 cm.
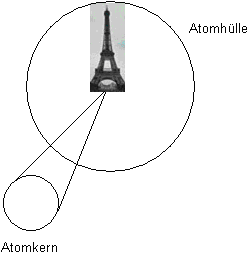
Deren Größenverhältnis ist mit 1:40000 etwa zehnmal so groß wie der Wert, der sich aus dem in der Schule
gern genutzten analogen Vergleich zwischen Tennisball (Radius 3,25 cm) und Kölner Dom (Höhe 157 m) ergibt:
Denn deren Größenverhältnis beträgt nur 1:4800.
2. Das Verhältnis der Volumina von Atomkern und Atom
Das Volumen des Atoms berechnen wir wie folgt:
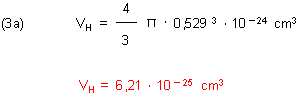
Das Volumen des Atomkerns ist natürlich wesentlich kleiner:
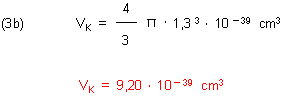
Das Verhältnis der zwei Volumina ist
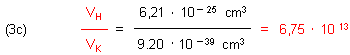
Abgerundet beträgt das Verhältnis der Volumina von Atomkern und Atom 1:1014.
Das H-Atom besteht also wirklich mehr oder weniger aus leerem Raum. Der Atomkern nimmt davon nur ein Hundertbillionstel ein. Erstaunlich, dass beim berühmten Streuversuch nach Rutherford überhaupt noch ein Atomkern getroffen wird…
1014 ist übrigens die Größenordnung der Zahl an Körperzellen, aus denen ein erwachsener Mensch besteht…
3. Die Dichte des Atomkerns
Die Masse eines Atoms muss also im klitzekleinen Atomkern zentriert sein. (Die Elektronenmasse lassen
wir als vernachlässigbare Größe unberücksichtigt.) Hier berechnen wir die Dichte des Atomkerns.
Dichte (r) ist Masse durch Volumen. Als Einheiten wählen wir von vornherein Tonnen und Kubikzentimeter. Wir teilen die Masse des Wasserstoffatomkerns durch sein Volumen:
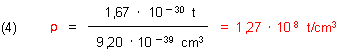
Runden wir großzügig ab:
Die Dichte eines Atomkerns beträgt etwa 100 Millionen Tonnen pro Kubikzentimeter!
Das ist zugleich auch die Dichte von Neutronensternen, die letztlich gigantische Atomkerne sind.
Ein Neutronenstern entsteht, wenn bei besonders massereichen Sternen die bei ihnen extrem rasch ablaufenden Nuklearreaktionen aufhören. Dann kollabieren die Sterne unter der Gravitation ihrer eigenen Masse und schrumpfen von vielen Millionen auf wenige Kilometer Durchmesser zusammen. Dabei verschwindet sogar der „leere“ Raum der Atome. Sogar die Elektronen werden in die Atomkerne gepresst, wodurch aus den Protonen Neutronen entstehen.
Last but not least
Das klingt alles kaum vorstellbar, ist aber real. Dabei wird auch wieder einmal deutlich, dass wir Probleme
mit Zehnerpotenzen haben. Zur Schwierigkeit beim Umgang mit großen oder kleinen Zahlen haben wir eine besondere
Webseite.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 16. April 2010, Dagmar Wiechoczek