Prof. Blumes Tipp des Monats März 2007 (Tipp-Nr. 117)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Das Quecksilberherz
Es sind harte Zeiten für den praktischen Chemieunterricht angebrochen. Vieles Alltägliche wird verboten. Für jede Chemikalie muss wie in der Industrie ein Gefahrenblatt angelegt werden. Kein Wunder, dass kein Lehrer mehr gern experimentieren will, deshalb prophylaktisch alle Chemikalien entsorgt und den Schülern nur noch beibringt, das Lernen zu lernen.
Aber entsorgen Sie nicht alles! Bewahren Sie sich zum Beispiel etwas Quecksilber auf. Damit kann man einen schönen Versuch machen. Hierzu ist allerdings eine ruhige Hand Voraussetzung!
|
Versuch 1: Das chemische Herz
Berührt man nun den Tropfen in der Lösung mit einem sauberen, entfetteten Eisennagel (keinen Stahlnagel!), so zieht sich der Tropfen zusammen. Dabei verliert letzterer den Kontakt zum Nagel und dehnt sich deshalb wieder aus. Dadurch berührt er wieder den Nagel (usw.). Ab und zu muss Kaliumpermanganatlösung nachgegeben werden, denn das Kaliumpermanganat wird offensichtlich verbraucht. Außerdem ist der Nagel zwischendurch mit Filterpapier zu putzen, denn er wird schwarz. Hinweis
|
 |
| Prof. Blume lässt das
Quecksilberherz schlagen
(Foto: Daggi) Hierzu gibt es einen Film (5,2 MB) Klicke hier |
Die Folge der Bewegung des Quecksilbertropfens ist ein rhythmisches Bewegen des Tropfens. Da sich dabei dreieckige Strukturen ausbilden, erinnert dies an das Schlagen eines Herzens. Im Allgemeinen bekommen die meisten Experimentatoren leider nur ein Kammerflimmern hin...
Quecksilber und Eisen sind unterschiedlich edle Metalle
Wenn sie sich berühren, zieht das edlere Quecksilber Elektronen zu sich herüber, es lädt sich als
positiver Pol zunehmend negativ auf. Wir könnten somit aus dem Versuchsaufbau eine Batterie bauen.
Ermitteln wir die Spannung zwischen den beiden Metallen.
|
Versuch 2: Spannungsmessung beim Quecksilberherz
|
Quecksilber ist Kathode, Eisen die Anode.
Das Eisen bildet wegen der Abgabe von Elektronen zum Ladungsausgleich Eisen(II)-Ionen.
Fe ———> Fe2++ 2 e-
Die Bildung von Eisen(II)-Ionen wird gefördert, indem sich das Eisen rasch mit schwarzem Eisenoxid überzieht. Sauerstoffspender ist das Kaliumpermanganat.
Dass auch das Quecksilber chemisch aktiv ist, erkennt man daran, dass sich auf der Oberfläche kurzfristig helle Überzüge bilden, die über das Metall ziehen, aber rasch wieder verschwinden. Es handelt sich hierbei um Wasserstoffbläschen. Alles spricht somit für eine katalysierte Korrosion des Eisens. (Dass ab und zu auch am Eisennagel Wasserstoffbläschen beobachtet werden, liegt an der einfachen Säurewirkung der recht konzentrierten Schwefelsäure, die bekanntlich auch unkatalysiert Eisen zu zersetzen vermag.)
Doch sind die Protonen der Schwefelsäure wirklich das Oxidationsmittel, das den Eisennagel zur Anode macht?
Die folgende Beobachtung bringt uns auf die richtige Fährte zur Beantwortung der Frage: Um das Quecksilber herum entfärbt sich das Kaliumpermanganat. Es nimmt nämlich anstelle der Wasserstoff-Ionen die Elektronen vom Quecksilber auf und bildet farblose Mangan(II)-Ionen.
MnO4- + 8 H+ + 5 e- ———> Mn2+ + 4 H2O
Dabei sind die Protonen aber äußerst hilfreich.
Die Gesamtreaktionsgleichung ist:
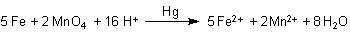
Wie ist das nun mit dem bewegten Quecksilbertropfen?
Die vom Eisen her einfließenden Elektronen besetzen vor allem die Oberfläche des Quecksilbers. Dadurch verstärkt sich
die Oberflächenspannung des flüssigen Metalls. (Man spricht von elektrischer Oberflächenpolarisation.)
Der Tropfen zieht sich somit zusammen und verliert dadurch den Kontakt zum elektronenspendenden Eisen.
Nun wird das Permanganat aktiv: Es befreit das Quecksilber von den überschüssigen Elektronen. Deshalb
dehnt sich der Tropfen wieder aus und bekommt wieder Kontakt zum Eisennagel. Er wird erneut geladen - die
Oszillation setzt ein.
Mit diesem Tipp verabschiede ich mich in den Ruhestand! Aber keine
Angst: Der Server bleibt weiter bestehen. Denn mein Herz schlägt weiter für die Chemie. Ich hoffe, dass es
das noch lange tun wird...
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 08. Januar 2012, Dagmar Wiechoczek