Prof. Blumes Tipp des Monats September 2007 (Tipp-Nr. 123)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Racematspaltung - Trennung von Enantiomeren
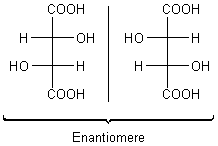
Enantiomere Verbindungen sind Stereoisomere, deren Molekülformen sich wie Bild und Spiegelbild verhalten (vom griechischen Wort enantios, entgegengesetzt). Sie sind Spiegelbild-Isomere. Man spricht auch von optischen Isomeren. Denn sie unterscheiden sich nur in einer Eigenschaft: In der optischen Aktivität. Die eine Form dreht den Vektor von polarisiertem Licht nach rechts (+), die andere nach links (-). Das beschrieb man früher auch mit den kleingeschriebenen Buchstaben d (lat. dexter, rechts) bzw. l (lat. laevus, links).
Typisch für den Aufbau solcher Strukturisomere ist, dass sie ein C-Atom mit 4 verschiedenen Substituenten enthalten. Dieses asymmetrische C-Atom oder ein Asymmetriezentrum kennzeichnet man oftmals mit einem Sternchen (C*). Ein anderer Begriff ist Chiralitätszentrum (vom griech. chiros, Hand). Die Stellung der Substituenten bezeichnet man mit den großgeschriebenen Buchstaben D und L.
Bekannte Beispiele sind vor allem biochemische relevante Verbindungen wie die Milchsäure.
Diese entstehen durch Reduktion von optisch inaktiver Brenztraubensäure CH3-CO-COOH.
Im Organismus oder bei der Milchgärung entsteht nur die L(+)-Form ("Gärungsmilchsäure" oder
"Rechtsmilchsäure"). Das Enzym ist die Lactat-Dehydrogenase (abgekürzt: LDH). Die
D(-)-Form
("Linksmilchsäure") tritt dabei nur als Nebenprodukt auf. Sie wird anders als die Rechtsmilchsäure
vom Körper nicht verwertet und erst im Darm durch Mikroorganismen abgebaut.
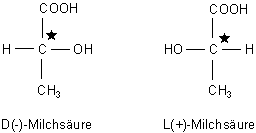
Auch vom Glycerinaldehyd gibt es zwei Formen.
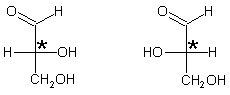
D(+)-Glycerinaldehyd L(-)-Glycerinaldehyd
Grundsätzlich erhält man Glycerinaldehyd, indem man optisch inaktives Glycerin oxidiert.
Das kann einmal enzymatisch durch eine Glycerin-Dehydrogenase erfolgen. Im Labor geschieht
dies durch Reaktion mit Wasserstoffperoxid und Fe(II)-Salz als Katalysator.
Im ersten Fall entsteht nur die biologisch aktive D(+)-Form. Die Lösung ist optisch aktiv.
Im anderen Fall bilden sich beide Spiegelbildisomere im Konzentrationsverhältnis 1:1. Dann ist
die Lösung nicht mehr optisch aktiv. Denn die Linksdrehung des polarisierten Lichts durch die
eine Form hebt die Rechtsdrehung durch die andere Form auf.
Wir halten also Folgendes fest:
| - | Biochemische Reaktionen führen im Allgemeinen zu einer reinen enantiomeren Form. Das liegt daran, dass durch die aktiven Zentren des Enzymmoleküls die Reaktionspartner sterisch exakt ausgerichtet werden. |
| - | Werden jedoch Verbindungen mit optisch aktiven Zentren im Labor synthetisiert, so erhält man im Allgemeinen eine 1:1-Mischung aus den beiden Enantiomeren. Man spricht von einer DL-Form oder besser von einem Racemat bzw. von einem racemischen Gemisch. Welche Form dabei entsteht, wird nur durch den Zufall bestimmt. Das können wir in einem "Versuch" zeigen. |
|
Versuch 1: Ein Modell-Racemat
|
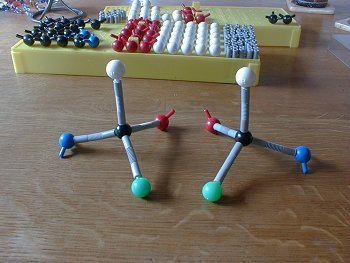
Bild 1: Molekülmodelle zweier enantiomerer Verbindungen
(Foto: Blume)
|
Wichtig: Wir machen das alles, ohne hinzusehen. Denn dann würden wir mehr oder weniger unbewusst doch steuernd eingreifen. |
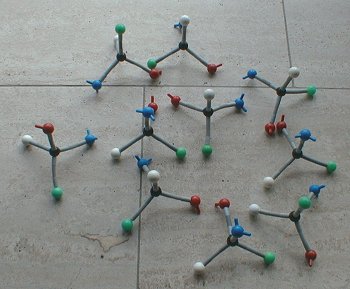
Bild 2: Molekülmodell eines (nahezu) racemischen Gemischs
(Foto: Blume)
|
Wenn jeder Schüler 5-6 solcher "Verbindungen" hergestellt hat, werden die Moleküle auf einem großen Tisch zusammengetragen und sortiert. Das sieht zunächst recht wild aus. Ihr könnt ja schließlich auch eure beiden Hände zueinander stellen, wie ihr wollt - sie bleiben doch immer eine linke und eine rechte Hand! Um die spiegelbildlichen Formen zu erkennen, muss man die Formen nur richtig gegenüberstellen. Ergebnis:
|
Je mehr Modelle wir bauen, desto mehr nähert sich das Gemisch dem Verhältnis 1:1 an. Das ist eine typische Eigenschaft statistischer Systeme. Denn umso größer die untersuchte Population ist, desto genauer stimmen die statistischen Gesetze. Zur Erhöhung der Population gehen uns leider die Molekülmodelle aus. Aber wir können ja auch würfeln!
|
Versuch 2: Das Racemat-Würfelspiel
Fazit:
|
Chemische Reaktionssysteme beruhen auf Individuenzahlen, die in den Bereich 1020
kommen. Deshalb ist die Bildung racemischer 1:1-Gemische bei ungesteuerten chemischen Reaktionen normal.
Ungesteuert heißt, dass sie ohne Beeinflussung ablaufen. Denn wenn wir z. B. spezielle Katalysatoren
(z. B. nach Natta und Ziegler) oder Enzyme einsetzen, sieht das
schon ganz anders aus.
Traubensäure - das klassische racemische Gemisch
Die Bezeichnung "Racemat" kommt vom lat. racemus, Weintraube. Die daraus gewonnene
Traubensäure nannte man deshalb schon "racemische Säure", als man noch gar nichts von Enantiomeren
wusste. Bei genaueren Untersuchungen zeigte sich, dass die Traubensäure ein Gemisch aus zwei Stoffen
sein musste. Das erkannte man z. B. am Schmelzverhalten der Mischung. Diese zwei Stoffe erwiesen sich
aufgrund der Arbeiten von Louis Pasteur als D- und L-Weinsäure.
Racemisches Gemisch der Weinsäure ("Traubensäure")
Wie kann man diese sich chemisch völlig gleich verhaltenden
Substanzen eines racemischen Gemischs voneinander trennen?
Die chemischen und physikalischen Eigenschaften der beiden Enantiomere, die das Racemat bilden,
sind gleich. Racemische Gemische zeigen keine optische Aktivität. Ihre Trennung ist deswegen schwierig.
Racemattrennung ist dennoch notwendig. Ein schlimmes Beispiel dafür ist das Thalidomid, Inhaltsstoff von Präparaten wie Contergan®. Thalidomid ist aufgrund seiner Synthese ein racemisches Gemisch, von dem nur ein Enantiomer die Missbildungen verursacht, während die andere reine Form als Mittel gegen einige Krebsformen und Lepra auch heute noch eingesetzt wird. Ein Grund für die unterschiedliche Wirkung ist wohl, dass die Thalidomid-Enantiomere im menschlichen Körper verschiedene Rezeptoren besetzen. Inzwischen hat man eine nicht chirale, nicht mehr teratogene (fruchtschädigende) Form entwickelt.
Dieses unterschiedliche Verhalten gegenüber Rezeptoren zeigt Möglichkeiten auf, wie man Enantiomere trennen kann. Denn Rezeptoren sind selbst optisch aktiv.
Aber gehen wir den historischen Weg.
A Physikalische (mechanische) Racemattrennung
Manche optisch aktiven Substanzen bilden zwei Reihen von Kristallen. Diese kann man manuell auslesen,
denn auch ihre Kristallformen verhalten sich wie Bild und Spiegelbild. Das ist zwar mühsam; aber so hat
Louis Pasteur im Jahre 1848 vor einem gestrengen Publikum die enantiomeren Weinsäureformen mit
einer Pinzette voneinander getrennt und somit bewiesen, dass Traubensäure kein neuer Stoff ist. Genau
genommen nutzte er dazu das Natrium-ammonium-salz der Traubensäure.
B Chemische Racemattrennung
Dazu überführt man Enantiomere in Diastereomere. Das sind optisch aktive Stereoisomere,
die sich nicht wie Bild und Spiegelbild verhalten. Beispiele sind die α-D-Glucose
und die β-D-Glucose. Die chemischen und physikalischen Eigenschaften zusammengehörender
Diastereomere sind stark voneinander verschieden.
Aber man kann auch aus zwei völlig verschiedenen Enantiomerenspezies Diastereomere herstellen. Hierzu ein einfaches Modell:
Linke und rechte Handschuhe lassen sich voneinander trennen, indem man versucht, alle Handschuhe über beispielsweise die linke Hand zu ziehen. Dann bleiben die "rechtshändigen" Handschuhe liegen. Obwohl sich linke und rechte Hand sowie linke und rechte Handschuhe jeweils wie Bild und Spiegelbild verhalten (es sind also zwei verschiedene Enantiomerenpaare), haben die möglichen Kombinationen D-D und D-L (die Diastereomere) "passende oder unpassende" Eigenschaften.
So kann man versuchen, Enantiomeren mit der einen oder anderen reinen Form eines anderen Enantiomerenpaars zu koppeln; es bilden sich dann möglicherweise unterschiedliche Diastereomere, die sich aufgrund großer Unterschiede z. B. in Löslichkeit oder Reaktivität trennen lassen. Im Folgenden beschreiben wir einige Möglichkeiten dazu.
1 Esterbildung
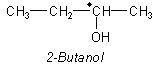
Optisch aktive, racemische Säuren werden mit einem optisch aktiven Alkohol verestert, z. B. mit (-)-Butanol-2.
Es gibt deshalb auch zwei Reihen von Estern:
(+)-Säure / (-)-Butanol (-)-Säure / (-)-Butanol
Umgekehrt geht das natürlich auch! Dann nimmt man zur Auftrennung eines racemischen Alkoholgemischs z. B. optisch reine Milchsäure oder Weinsäure.
2 Salzbildung
Optisch aktive Säuren bilden mit optisch aktiven Basen diastereomere Salze. Viele dieser Trenn-Substanzen
sind höllisch giftig. Denn solche Basen sind z. B. der optisch reine Naturstoff (-)-Strychnin bzw. sein
Dimethoxy-Derivat (+)-Brucin.
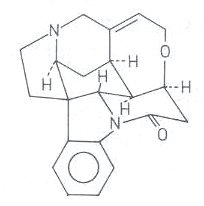
(-)-Strychnin
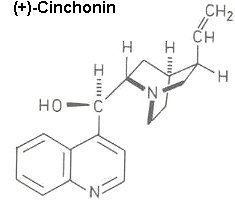
Weitere Beispiele für optisch aktive Basen sind (-)-Chinin und (-)-Morphin sowie andere Alkaloide. Auch das (+)-Cinchonin ist hier zu nennen, ein chininähnliches Alkaloid des Chinarindenbaums.
Gibt man eine entsprechende optisch reine Base zur Lösung einer racemischen Säure, so bilden sich zwei Formen von Salzen:
(+)-Säure / (-)-Base (-)-Säure / (-)-Base
Diese Salze zeigen unterschiedliche Löslichkeiten und können deshalb durch fraktionierte Kristallisation getrennt werden. Sie unterscheiden sich auch in ihrem Schmelzpunkt.
Hier ein Beispiel: Die racemische D,L-Mandelsäure C6H5-*CH(OH)-COOH wird durch (+)-Cinchonin in ihre beiden enantiomeren Formen getrennt.
| Salz gebildet aus: | Schmelzpunkt
(°C) |
Löslichkeit bei 20 °C
(g/Liter Wasser) |
[a]D |
| D(-)-Mandelsäure + (+)-Cinchonin | 80 | 10,8 | +152 |
| L(+)-Mandelsäure + (+)-Cinchonin | 165 | 20,5 | +92 |
Die D(-)-Mandelsäure ist die im Amygdalin natürlich vorkommende Form.
Die Rückgewinnung der Base erfolgt, indem man das jeweils abgetrennte diastereomere Salz mit Salzsäure behandelt.
Umgekehrt geht das natürlich auch. Man nimmt dann ein racemisches Basengemisch, das man mit einer optisch reinen Säure wie der D-Mandelsäure reagieren lässt. Nach Trennung der diastereomeren Salze wird die Base mit Natronlauge freigesetzt.
3 Chromatographische Trennung
Ionenaustauscher können optisch aktive Ankergruppen tragen.
Sie halten dann eine der beiden enantiomeren Formen zurück, während die andere ohne adsorbiert zu werden
durchfließt.
Man hat auch Säulen für Gaschromatographen entwickelt, deren Belegung aus reinen
Enantiomeren besteht. Sie spielen eine wichtige Rolle bei der Untersuchung von Biostoffen wie den Pheromonen.
Das sind vor allem bei Insekten verbreitete Sexuallockstoffe, von denen allerdings immer nur ein Enantiomer
wirksam ist.
4 Partieller enzymatischer Abbau
Enzyme sind selbst optisch aktive Substanzen. Das rührt von ihrem Aufbau ausschließlich aus L-Aminosäuren
her. Der Anlagerungskomplex zwischen Enzym und Substrat bzw. der reaktive Übergangskomplex sind somit diastereomere
Verbindungen, wie wir es soeben bei den Salzen gesehen haben. So wird nur eine enantiomere Form umgesetzt; die andere Form
bleibt in der Lösung zurück.
Diese enzymatische Selektion ist wahrscheinlich Grundlage für die Entdeckung Pasteurs, der um 1860 bemerkte, dass Mikroorganismen eine Lösung von racemischer Weinsäure ("Traubensäure") derart veränderten, dass die zuvor optisch inaktive Mischung zunehmend linksdrehend wurde.
Der Nachteil der Methode ist, dass durch sie gerade diejenigen Moleküle abgebaut werden, die als Substrate für biochemische Untersuchungen erwünscht sind. Aber die Methode ist dann gut anwendbar, wenn man nur zeigen will, dass es sich bei einer Substanz um ein racemisches Gemisch handelt.
5 Fotoreaktionen mit polarisierter Strahlung
Darunter versteht man Reaktionen, die unter der Beteiligung von Licht (besser: elektromagnetischer Strahlung)
ablaufen. Man muss wissen, dass sich ein linearer Schwingungs-Vektor durch Überlagerung zweier spiraliger, gegenläufiger
Strahlen darstellen lässt. Aus Kreisfunktionen wird - wenn man den Drehwinkel gegen die Zeit aufträgt - bekanntlich
eine Sinus-Schwingung. Hinzu kommt, dass die optisch aktiven Substanzen ihre Substituenten so angeordnet haben, dass man
sie auch mit einer Kreisbewegung beschreiben kann. Darauf beruht z. B. das R/S-System von
Cahn-Ingold-Prelog. Mit derart circular polarisiertem Licht führen Fotoreaktionen
bei optisch aktiven, racemischen Verbindungen zum Abbau nur einer Form, während sich die andere damit anreichert.
Das lässt sich als eine rein physikalische Methode auffassen. Man kann aber auch argumentieren, dass entsprechend polarisiertes Licht mit dem optisch aktiven Molekül eine diastereomere Einheit eingeht. Diese werden dann schematisch wie folgt beschrieben:
(+)-Molekül / (+)-Strahlung (-)-Molekül / (+)-Strahlung
Wie werden verschieden gedrehte Schnecken getrennt?
Bei Weinbergschnecken bildet eine unter Zwanzigtausend ein linksdrehendes Gehäuse. Diese besondere Schnecke nennt man
"Schneckenkönig". Im naturwissenschaftlichen Jargon nennt man entsprechende Schnecken "Rechtser" oder "Linkser".


Bild 3 (Fotos: Andreas)
Es gibt allerdings auch Schneckenarten, bei denen Links- und Rechtsformen im Verhältnis 1:1 auftreten. Das
ist sozusagen ein Schneckenracemat...
Auch hier gibt es Trennverfahren, die dem physikalischen Bereich zuzuordnen sind.
1 In Ostasien lebt eine Schlange (Pareas iwasakii), die auf das Jagen von
Gehäuseschnecken spezialisiert ist. Sie hat es "gelernt", mit einer entsprechenden Drehbewegung ihres
Kopfes die Schnecke aus ihrem Häuschen zu holen. Sie hat sogar ihren Kieferapparat so angepasst, dass
sie nur Rechtser vernaschen kann. Ihr fehlen im linken Kiefer schlicht die Zähne zum Zupacken. Auch hier
haben wir es letztlich mit einem diastereomeren Gebilde zu tun.
Die Linkser überleben, weil die Schlange sie nicht herausholen kann. Das ist ein schönes Beispiel für das
Wirken der Evolution... Der SPIEGEL schreibt in seiner unnachahmlichen Art und Weise: "Diese Schnecke hat den
richtigen Dreh zum Überleben gefunden."
2 Wie Schneckenkönige von französischen Arbeitern "diastereomer" selektiert werden, beschreiben wir hier.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 08. Januar 2012, Dagmar Wiechoczek