Prof. Blumes Tipp des Monats November 2010 (Tipp-Nr. 161)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Wie man eine Redox-Gleichung schrittweise herleitet
Die Anfragen zeigen es: Immer wieder gibt es auch bei fortgeschrittenen Schülern oder Studenten Probleme, wenn es um die Herleitung von Reaktionsgleichungen geht. Am schwersten scheinen wohl die Gleichungen zu sein, mit denen man Redox-Reaktionen beschreibt. Bei denen werden zwischen zwei Stoffen Elektronen ausgetauscht. Man spricht deshalb von Elektronenaustausch-Reaktionen.
Bei einfachen Reaktionen geht es ja noch. Zum Beispiel die Verbrennung von Magnesium:
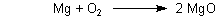
Aber wenn es dann komplizierter wird – wie z. B. bei den Reaktionen mit Kaliumpermanganat
- steigen viele Schüler und Studenten aus. Und dabei ist die Manganometrie
immer noch ein sehr wichtiges quantitatives Analyseverfahren. Klicke
hier.
Zunächst einmal ein chemisches Experiment, dessen Ablauf wir anhand einer Redox-Gleichung beschreiben wollen. Dieses Experiment können wir mit unserem Chemiebaukasten auch zu Hause durchführen.
Klick mich an!
Bild 1: Chemikalien für Versuch 1: Kaliumpermanganat und Eisen(II)-sulfat-heptahydrat
(Fotos: Blume)

Bild 3: Nachweis von Eisen(III) mit Rhodanid
(Fotos: Blume)
Allgemeines zur Herleitung von Redox-Reaktionsgleichungen
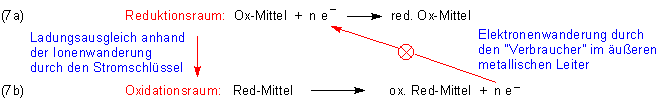
Zur Herleitung zerlegen wir die Redoxreaktion formal in zwei Teile, in die Reduktion des Oxidationsmittels
und die Oxidation des Reduktionsmittels. Die beiden Reaktionen werden über die auszutauschenden Elektronen verbunden.
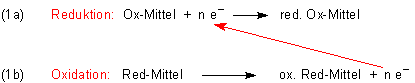
Wenn wir diese Gleichungen nach den Regeln der Algebra addieren, muss die Elektronenzahl als Hilfsgröße wegfallen:
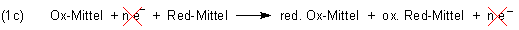
Auf diese Weise erhalten wir die endgültige Redox-Reaktionsgleichung.
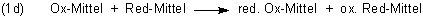
Der Reduktionsteil
Wir betrachten zunächst die Reduktion des Oxidationsmittels Kaliumpermanganat. In diesem liegt Mangan in der
Oxidationsstufe (+VII) vor. Dieses wird im Sauren zum farblosen Mangan(II)-Ion reduziert.
Zur Herleitung beginnen wir mit stark vereinfachten Reaktionsgleichungen.
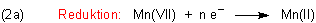
Um von der Mangan-Oxidationsstufe (+VII) zu (+II) zu gelangen, sind 5 Elektronen notwendig: n = 5.
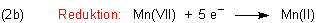
Mangan(VII) liegt in der Form des Permanganat-Ions vor. Das Kalium-Ion lassen wir weg, da es
am Redox-Geschehen nicht teilnimmt. Mn(II) liegt in Lösung als Mangan(II)-Ion vor. Wir kümmern uns auch nicht
darum, dass genau genommen Mangan(II)-aquo-Komplexe vorliegen.
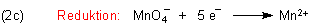
Nun müssen wir uns um die vier gebundenen Sauerstoffatome kümmern. Dieser Sauerstoff mit der Oxidationszahl
(-II) nimmt nicht am Redox-Geschehen teil, muss aber vom Permanganat-Ion abgespalten werden.
Ein wichtiger Reaktionspartner, der bei der Elektronenübertragung normalerweise nicht teilnimmt und an den man meistens bei der Herleitung von Redox-Reaktionsgleichungen nicht denkt, ist das Wassersystem: Wasser, Hydronium-Ionen und Hydroxid-Ionen.
In unserem Beispiel handelt es sich um die Hydronium-Ionen. Zur Vereinfachung schreiben wir zunächst nur Protonen. Als Produkt entsteht Wasser, in dem der Sauerstoff seine Oxidationsstufe (-II) behalten hat. Für die formale Reaktion zwischen O2- und H+ benötigen wir insgesamt 8 Protonen:
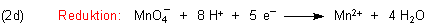
Damit haben wir die Reduktion des Permanganats abgehandelt. Zur Kontrolle überprüfen wir, ob die Ladungszahl
links und rechts übereinstimmt (hier: 2+).
Der Oxidationsteil
Nun kümmern wir uns um das Reduktionsmittel.
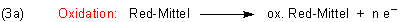
Eisen(II) wird – wie wir mit Thiocyanat nachgewiesen haben – zu Eisen(III) oxidiert. Dabei wird nur ein Elektron
abgespalten: n = 1.
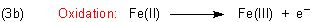
Die Eisenteilchen liegen als Ionen vor.
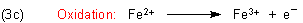
Damit ist auch die Oxidationsgleichung fertig.
Die Redox-Reaktionsgleichung
Wir schreiben die Gleichungen (2d) und (3c) wieder übereinander.
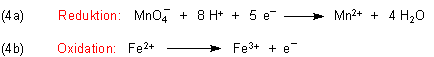
Zur Herleitung der Gesamtgleichung müssen wir die Gleichungen (4a) und (4b) addieren. Damit die Elektronen
als Hilfsgröße wegfallen, müssen wir die Gleichung (4b) mit 5 multiplizieren:
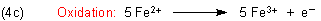
Nun erst erhalten wir durch Addition die entsprechende Gesamtgleichung:
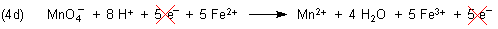
Durch eine Umstellung zur „Verschönerung“ der Gleichung erhalten wir endlich die endgültige Redox-Reaktionsgleichung,
wie sie auch in Lehrbüchern steht.
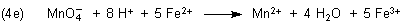
Zur Überprüfung empfehle ich, die Zahl der Ladungen zu zählen. Sie muss auf beiden Seiten der Gleichung gleich
sein (hier: 17+). Wir können auch nachzählen, ob die Zahl der Atomarten links und rechts übereinstimmt.
Wichtig: Es sollte darauf verzichtet werden, die am Reaktionsgeschehen nicht beteiligten Ionen wie K+ oder SO42- zu berücksichtigen, um eine endgültige, alles umfassende (also eine „buchhalterisch exakte“) Reaktionsgleichung zu erhalten. Diese Gleichungen erfordern weitere Rechenschritte, die oftmals zu Fehlern führen. Und dazu machen Sie die Gleichungen für Ihre Schüler unnötig schwierig: Die Einsicht in das eigentliche Reaktionsgeschehen geht dann verloren.
Manganometrie im neutralen oder alkalischem Milieu
Was ist, wenn die Reaktion statt im Sauren im Neutralen oder Alkalischen abläuft? Dann bildet sich aus Permanganat
nicht Mn(II), sondern Mn(IV) in der Form von festem Braunstein MnO2.
Hierzu müssen wir die Gleichungsgruppe (2a-2d) umformulieren.
Um von der Oxidationsstufe (+VII) zu (+IV) zu gelangen, sind 3 Elektronen notwendig: n = 3.
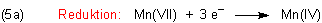
Formal schreiben wir erst einmal ergebnisorientiert, ohne auf die Stöchiometrie
zu achten:
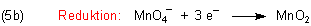
Nun müssen wir uns wieder um die vier gebundenen Sauerstoffatome kümmern. Dieser Sauerstoff mit der Oxidationszahl
(-II) nimmt auch hier nicht am Redox-Geschehen teil. Zwei bleiben am Mangan-Atom. Die zwei anderen müssen vom
Permanganat-Ion abgespalten werden. Das wird mit der Brönsted-Säure Wasser gemacht:
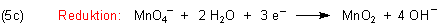
Nun können wir durch Addition von Gleichung (3c) die Redox-Reaktionsgleichung der Manganometrie im neutralen
bzw. alkalischen Milieu herleiten.
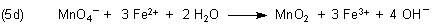
Hier sollten wir nicht weiter darauf eingehen, dass sich je nach Anzahl der Hydroxid-Ionen festes
Eisen(III)-hydroxid Fe(OH)3 bildet. Denn auch das würde einen zusätzlichen, unnötigen Rechenaufwand
erfordern.
Und wie sieht die Redox-Reaktionsgleichung aus, wenn zum
Beispiel Silber-Ionen Kohlenmonoxid oxidieren?
Dieser Versuch dient als nasschemischer Nachweis von CO. Klicke hier.
Die Herleitung der Redox-Reaktionsgleichung ist ganz einfach - aber nur, wenn wir wieder das Wassersystem einbeziehen. Denn der Sauerstoff zur Bildung von CO2 aus CO stammt aus dem Wasser! Die Elektronen, die die eigentliche Redoxreaktion bewirken, werden von den Silber-Ionen übernommen – und nicht vom gelösten Luftsauerstoff (wie manche meinen).
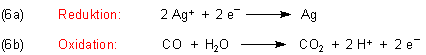
Die Gesamtgleichung ist:
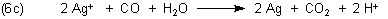
Last but not least
In der Gleichungsgruppe (1) haben wir die Redox-Teilreaktionen (1a) und (1b) mit einem Richtungspfeil des
Elektronenflusses verbunden. Bleibt noch die Überlegung, ob man mit den Ingredenzien („Zutaten“) von Versuch 1 ein
Galvanisches Element bauen könnte.
|
Versuch 2: Ein Galvanisches Element mit Kaliumpermanganat und Eisen(II)-sulfat
|

Bild 4: Aufbau zu Versuch 2
(Foto: Daggi)
Wir sehen, dass die aus Übersichtsgründen erfolgte formale Teilung der Redox-Reaktionen in einen Oxidations- und einen Reduktionsteil durchaus auch physikalisch-technische Realität abbildet und letztlich den Versuchsaufbau für ein Galvanisches Element beschreibt.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 20. Januar 2011, Dagmar Wiechoczek

