Versuch: Manganometrische Bestimmung der Konzentration von Eisen(II)-Ionen mit einer Low-Cost-Titrationsapparatur
Schülerversuch; 30-45 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Geräte
Messpipette (5 ml oder 10 ml), Einmalspritze (20 ml oder 30 ml), passendes Schlauchstück (evt. mit Luer-Verbindung zur Spritze),
2 Messkolben (1 l), Erlenmeyerkolben oder Becherglas für die Probenlösung, Becherglas für die Maßlösung, Stativ, Laborwaage (Genauigkeit 0,01 g)
Chemikalien und Material
Eisenhaltige Probenlösung, Vergleichsprobe (Eisen(II)sulfat-Heptahydrat, c(FeSO4 ⋅ 7 H2O (c = 1 mmol/l)), Maßlösung (Kaliumpermanganat c(KMnO4 = 1 mmol/l)), Destilliertes Wasser, 25%ige Schwefelsäure
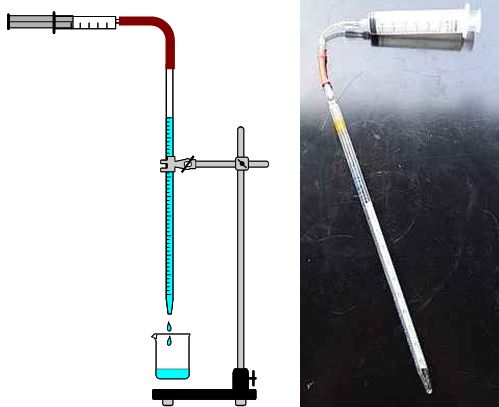
Bild 1: Aufbau der Titrationsapparatur
(Skizze und Foto: Lüttgens)
Durchführung
1 Baue die Titrationsapparatur zusammen und spanne sie in ein Stativ ein.
2 Stelle eine 0,001 molare Kaliumpermanganat-Maßlösung und eine 0,001 molare Vergleichslösung her. (Das macht freundlicherweise die Lehrperson!)
Hinweis zur Herstellung der Maßlösung und der Vergleichslösung:
In einen 1 l Messkolben legt man etwas destilliertes Wasser vor, gibt möglichst genau 0,16 g KMnO4 (M = 158 g/mol) hinzu, schüttelt kurz und füllt bis kurz vor dem Eichstrich mit weiterem destilliertem Wasser aus der Spritzflasche auf. Um korrekt bis zum Eichstrich aufzufüllen, ist eine geeignete Pipette hilfreich. Nun sollte man waagerecht auf den Meniskus der Flüssigkeit blicken, um korrekt bis zum Eichstrich auffüllen zu können. Für eine entsprechende Vergleichslösung sind 0,28 g FeSO4 ⋅ 7 H2O (M = 278 g/mol) einzuwiegen. Sollten geringere Mengen benötigt werden, ist entsprechend umzurechnen.
3 Bereite deine Probenlösung vor. Falls Fe(III)-Ionen in der Lösung vermutet werden, ist eine Spatelspitze Zinn(II)chlorid zuzugeben. (Dadurch werden die Fe3+-Ionen quantitativ in Fe2+-Ionen überführt.) Die Lösung wird trüb. Durch Zugabe von einigen Millilitern Schwefelsäure klart die Lösung wieder auf.
4 Ziehe die Messpipette mit der Maßlösung auf. Stelle dazu ein kleines Becherglas mit der Maßlösung unter deine Apparatur. Diese Maßlösung ziehst du nun von unten in die Pipette, indem du langsam den Stempel nach oben aus Spritze ziehst. Achtung: Häufiger wird versucht, die Titrationsapparatur von oben über die Spritze zu füllen. Das ist falsch!
5 Anfangs kannst du die Titrierlösung zügiger zulaufen lassen. Später, wenn die Entfärbung der hinzutropfenden Maßlösung zunehmend länger dauert, sollte die Zugabe weiterer Maßlösung aus der Pipette langsamer und nur tropfenweise erfolgen. Kurz vor dem Äquivalenzpunkt wird das Becherglas oder der Erlenmeyerkolben mit der Probenlösung nach jedem Tropfen gut geschüttelt. Beobachte den Farbumschlag genau.
Versuchsergebnis
Bleibt die Probenlösung im Becherglas trotz Schütteln schwach rosa gefärbt, ist der Endpunkt der Titration erreicht.
Auswertung: Berechnung der Eisen(II)-Ionen-Konzentration
Aus der Reaktionsgleichung
MnO4- + 5Fe2+ + 8H+ → Mn2+ + 5Fe3+ + 4H2O
können wir das Stoffmengenverhältnis entnehmen, indem die Eisen(II)-Ionen mit den Permanganat-Ionen reagieren:
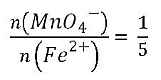
Was sagt uns das? Es muss 1/5 der Stoffmenge an Permanganat-Ionen eingesetzt werden, um eine bestimmte Stoffmenge an Eisen(II)-Ionen umzusetzen.
Man kann es auch anders ausdrücken: Um beispielsweise 1 mol Fe2+-Ionen zu Fe3+-Ionen zu oxidieren, werden 0,2 mol MnO4--Ionen benötigt.
1 Bestimmung der Stoffmengenkonzentration Also ergibt sich die Grundgleichung für die Titration zu:
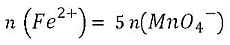
Mit der Formel für die Stoffmengenkonzentration c = n/V ergib sich:
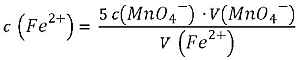
Die Konzentration der Maßlösung c(MnO4-) beträgt 1mmol/l. Und das Volumen V(MnO4-), das du für bei der Titration verbraucht hast, kannst du an der Pipette ablesen.
Also kannst du alle drei Werte in die Gleichung oben einsetzen und damit die Konzentration der Eisen-Ionen in deiner Lösung berechnen.
Ein Beispiel für die Bestimmung der Eisen(II)-Ionen-Konzentration: 24 ml einer 0,001molaren Maßlösung wurden verbraucht, die Probenlösung hatte ein Volumen von 100 ml:
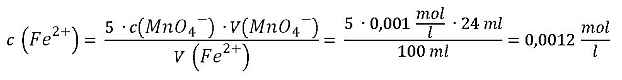
2 Bestimmung der Massenkonzentration Nun musst du noch aus der Stoffmengenkonzentration die Massenkonzentration der in der Probenlösung enthaltenen Eisen-Ionen bestimmen. Denn Grenzwerte werden in der Einheit g/l oder mg/l angegeben und nicht in mol/l oder mmol/l.
Mit den beiden gegebenen Formeln für die Stoffmenge n
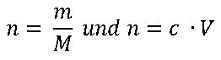
ergibt sich
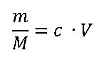
und nach Umformung:
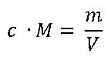
Unsere Rechnung: Jetzt muss die Molmasse von Eisen M(Fe) = 55,85 g/mol eingesetzt werden, damit sich aus der Stoffmengenkonzentration c die Massenkonzentration m/V bestimmen lässt:
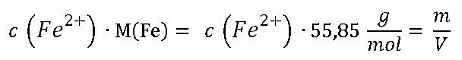
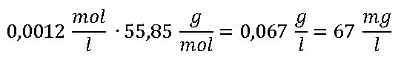
Die Antwort: Die Konzentration an Eisen(II)-Ionen in der untersuchten Probe beträgt 67 mg/l.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 31. Juli 2016, Fritz Meiners