Prof. Blumes Bildungsserver für Chemie
Tipp des Monats August 2016 (Tipp-Nr. 229)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Ist mein Brunnenwasser genießbar?
Uwe Lüttgens
Ich erinnere mich noch an das erste Frühjahr im eigenen Garten: Meine Frau und ich wollten uns einen leckeren Kaffee brauen und den Tag genießen. Die Sonne schien und die Freude auf das koffeinhaltige Getränk war groß. Da die Vorbesitzer des Gartens häufig am Wochenende dort verweilten, gingen wir davon aus, dass sie das Brunnenwasser auch zur Getränkeaufbereitung und nicht nur zur Bewässerung nutzten. Wahrscheinlich eine Fehlannahme! Denn ein kritischer Blick auf das Wasser, das aus dem alten Brunnen stammte, ließ uns von unserem Vorhaben schnell abrücken. Bild 1: Abgefülltes Brunnenwasser
Bild 2: Erste Analyse des Brunnenwassers
Mit dem „Wasserlabor“ lassen sich rasch auch von Laien erste Untersuchungen zu pH-Wert, der Gesamthärte des Wassers und zu den Konzentrationen der für die Wasserqualität relevanten Ammonium-, Nitrat- und Nitrit-Ionen durchführen. Allerdings findet sich im Begleitheft zu dem „Wasserlabor“ ein wichtiger einschränkender Hinweis: „Die hier verwendeten sogenannten „halbquantitativen“ Schnelltests sind zwar sehr genau […], sie können und sollten jedoch keine vom Fachmann angewandten Labormethoden ersetzen.“ Also fragten wir die Fachleute: Die Ergebnisse wurden anschließend mit der Analyse eines beauftragten Umweltlabors [2] verglichen, um zu sehen, wie sauber wir gearbeitet hatten und wie gut die Schnelltests funktionieren. Und hier das Ergebnis:

(Foto: Lüttgens)
Eine erste Prüfung
Nun beauftragte ich meine Leistungskurs-Schülerinnen und -Schüler mit einer ersten Prüfung des Wassers. Dazu nutzten wir das „Ökotest Wasserlabor“ [1].
(Foto: Lüttgens)
Vergleich der schnellen Prüfung auf Gesamthärte, pH-Wert und relevante Ionen mit einer professionellen Laboranalyse
Parameter
Grenzwert
Messwert
Eigene Sichtprüfung
Potsdamer Wasser- und Umweltlabor
Farbe
gelblich
gelblich
Trübung
ohne
ohne
Geruch
ohne
ohne
Aquanal-Ökotest Wasserlabor
Potsdamer Wasser- und Umweltlabor
pH-Wert
6,5 - 9,5
6,5
6,76
Leitfähigkeit 20 °C
<2500 µS/cm
8761
858 µS/cm
Gesamthärte
18 °dH
23 °dH
Ammonium-Ionen
0,5 mg/l
0,1 mg/l
0,1 mg/l
Nitrat-Ionen
50 mg/l
0 mg/l
<0,5 mg/l
Nitrit-Ionen
0,5 mg/l
≤0,02 mg/l
≤0,01 mg/l
1Gemessen mit dem Leitfähigkeitsmessgerät DIST 3 von HANNA
Unsere Ergebnisse brauchen sich, wie ich finde, nicht gegenüber der professionellen Analyse verstecken.
Übrigens: Für eine solche Analyse der „anorganischen Parameter“, bei der weiterhin der Fluorid-, Sulfat-, Kalium-, Calcium- und Magnesiumwert und einige weitere Summenparameter wie z.B. Oxidierbarkeit, Säurekapazität oder auch der Gesamtgehalt an organischem Kohlenstoff bestimmt werden, sollte ein Betrag von um die 100 Euro veranschlagt werden. Alle diese genannten Werte zeigten bei meinem Brunnenwasser keine weiteren Auffälligkeiten.
Und wie sieht es mit Eisen aus?
Am Brunnenhahn sind die braunen Ablagerungen nicht zu übersehen. Hier muss Eisen im Spiel sein.

Bild 3: Der Hahn am Brunnen
(Foto: Lüttgens)
Nun sollten meine Leistungskurs-Schülerinnen und -Schüler natürlich auch die Eisenkonzentration bestimmen. In einem ersten Vorversuch mit einer angesäuerten Probe zeigte sich nach Zugabe von Ammoniumthiocyanat eine blass rötliche Einfärbung. (Vergleiche Tipp-Nr. 161) Nachdem die Wasserprobe eingedampft wurde, zeigte sich im Konzentrat die entlarvende rötliche Färbung deutlich. Tatsächlich: Wir konnten Eisen-Ionen nachweisen, wie der Vergleich mit einer 0,001 molaren Eisen(III)-chlorid-Lösung zeigt.
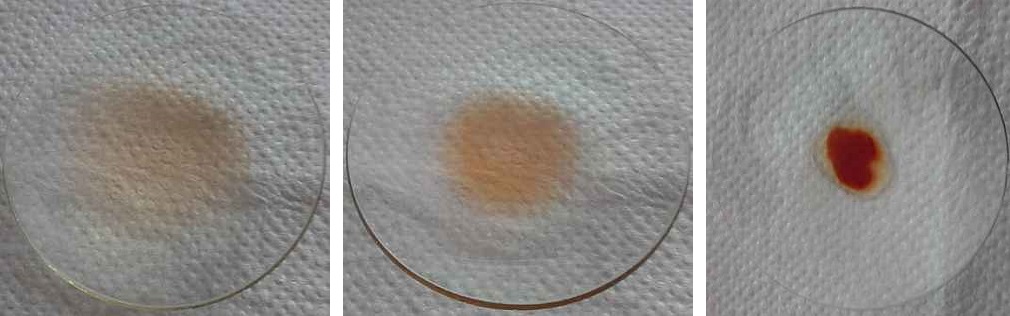
Bild 4: Qualitativer Eisennachweis im Brunnenwasser (v.l.n.r. Brunnenwasser, eingedampftes Brunnenwasser, Vergleichsprobe)
(Foto: Lüttgens)
Daher ließ ich im Umweltlabor gleich noch die Konzentrationen für Eisen und Mangan mit bestimmen. Und tatsächlich: Die Werte lagen jeweils mit über einer Größenordnung deutlich über den erlaubten Grenzwerten, wie wir aus der Tabelle entnehmen können.
Ergebnis der professionellen Analyse
| Parameter | Grenzwert | Messwert Potsdamer Wasser- und Umweltlabor |
|---|---|---|
| Eisen | 0,2 mg/l | 3,188 mg/l |
| Mangan | 0,050 mg/l | 0,759 mg/l |
Zur quantitativen Bestimmung eignet sich die Manganometrie. Diese Redox-Titration wurde hier bereits beschrieben: Oxalsäure und Manganometrie Versuch: Gehaltsbestimmung einer Oxalsäurelösung unbekannter Konzentration durch manganometrische Titration
Unsere manganometrische Bestimmung mit einer Low-Cost-Apparatur
Die Beschreibung des Versuchs findet sich in guten Schulbüchern [3], eine genauere Erläuterung findet sich beispielsweise in den „Grundlagen der quantitativen Analyse“ [4].
Klick mich an!
Bild 5: Titration
(Foto: Lüttgens)
Man sollte die manganometrische Eisenbestimmung möglichst im sauren Medium durchführen, da sie hier problemlos abläuft. Anhand der Reaktionsgleichung
MnO4- + 5Fe2+ + 8H+ → Mn2+ + 5Fe3+ + 4H2O
erkennen wir, dass in dieser Redox-Reaktion Eisen(II)-Ionen zu Eisen(III)-Ionen oxidiert werden, während Permanganat-Ionen – Mangan hat hier die Oxidationsstufe +VII - zu Mangan(II)-Ionen reduziert werden.
Für unsere Eisenbestimmung haben wir eine einfache Titrationsapparatur mit medizintechnischem Material genutzt [5]. Benötigt werden eine medizinische Spritze, eine Messpipette und eine passende Verbindung dazwischen.
Klick mich an!
Bild 6: Durchführung der Titration
(Foto: Lüttgens)
Die Wiederfindungsrate
Um die Qualität der Analyse bewerten zu können, sollte die Wiederfindungsrate geprüft werden: Wir müssen schauen, ob wir eine bekannte Menge an Eisen(II)-Ionen, die wir in einer Probenlösung vorliegen haben, überhaupt wiederfinden – daher der Name dieses Gütekriteriums. Ein Wert nahe 100% wäre natürlich ideal.
Dazu haben wir als Probenlösung eine 0,001 molare Eisensulfat-Lösung angesetzt und bei der manganometrischen Eisenbestimmung mit der Low-Cost-Apparatur anschließend in dieser Probe 0,00104 mol Eisen(II)-Ionen nachgewiesen:
Wiederfindungsrate = 0,00104 mol / 0,001 mol = 1,04
Ein hervorragender Wert! Und das mit einer Low-Cost-Apparatur. Wir können also relativ sicher sein, dass diese Analysemethode gut funktioniert. Allerdings liegen die dann mit dem Brunnenwasser erzielten Messwerte mit dieser einfachen Methode für Eisen mit 10 mg/l und mehr auffällig über dem professionell bestimmten Messwert.
Welche Probleme könnte es mit der Analysemethode geben?
Ein Problem ist die frisch angesetzte Kaliumpermanganat-Lösung. Steht sie lange ´rum, beginnt sich das Permanganat-Ion zu zersetzen, bevor die Maßlösung überhaupt erst verwendet wird. Dazu reichen bereits kleine Verunreinigungen an der Glaswandung des Messkolbens, in dem die Maßlösung angesetzt wird - was natürlich zur Abnahme der Genauigkeit und zu entsprechend höheren Messwerten, aber sicherlich nicht zu einer derartig großen Verfälschung führen kann. Profis bestimmen daher die tatsächliche Konzentration der Maßlösung durch Titration mit einer Probenlösung bekannter Konzentration. Das wäre aber für schulische Zwecke wahrscheinlich etwas übertrieben?!
Es gibt ein weiteres Problem: Was ist mit den Eisen(III)-Ionen Fe3+, die sich bereits im Wasser befinden und daher mit dieser Methode so nicht miterfasst werden können? Ganz einfach: Die „reduziert man mit einem geringen Überschuss von SnCl2“ [3]:
Sn2+ + 2Fe3+ → Sn4+ + 2Fe2+
Aber was heißt „geringer Überschuss“ an Zinn(II)chlorid? Wir haben es mit einer Spatelspitze auf 100 ml Probenlösung versucht. Die nach Zugabe von Zinnchlorid milchig trübe Probe wird durch Zugabe von Schwefelsäure und Schütteln wieder klar. Allerdings trübt sich die klare Lösung während der Titration erneut etwas ein, so dass der Endpunkt schwerer zu erkennen ist und sicherlich ein Mehrverbrauch an Maßlösung angenommen werden kann.
Ein weiteres Problem können im Wasser vorhandene Chlorid-Ionen sein: Sie werden ebenfalls durch Permanganat-Ionen oxidiert und verfälschen so das Ergebnis weiter:
MnO4- + 8H+ + 5Cl- → Mn2+ + 2,5Cl2 + 4H2O
Diese unerwünschte Nebenreaktion erhöht insbesondere dann den Verbrauch der Maßlösung, wenn das Wasser hohe Konzentrationen an Eisenchlorid enthält. Für meine Wasserprobe wurde ein Chlorid-Gehalt von immerhin 66 mg/l gemessen.
Ebenfalls problematisch können die vorhandenen Mangan-Ionen sein, die in meinem Brunnenwasser enthalten sind. Durch Komproportionierung bilden sich Mn3+-Ionen:
MnO4- + 4Mn2+ + 8H+ → 5Mn3+ + 4H2O
Da von Mn2+-Ionen in der Probenlösung auszugehen ist, verfälscht sich das Messergebnis weiter.
Mein Fazit
Die Ergebnisse der Messungen meiner Leistungskurs-Schülerinnen und -Schüler sind brauchbar. Sie können zwar nicht mit einer professionellen Analyse mithalten, geben aber zumindest gute Anhaltspunkte.
Das Brunnenwasser ist als Trinkwasser sicherlich unbrauchbar – und besonders, wenn man sich auf einen leckeren Kaffee freut.
Literatur:
[1] Aquanal-Ökotest Wasserlabor, Gebrauchsanweisung 37557, Art. Nr. 37801, Sigma-Aldrich Laborchemikalien GmbH, Seelze 2012
[2] PWU - Potsdamer Wasser- und Umweltlabor GmbH, Schlaatzweg 1 A, 14473 Potsdam, http://pwu-potsdam.de
[3] Chemie Oberstufe, Cornelsen Verlag, Berlin 2010, S.202
[4] Udo R. Kunze: Grundlagen der quantitativen Analyse, Georg Thieme Verlag, Stuttgart 1980, S. 140 ff.
[5] „Low-cost Experimente“ - Versuche mit medizintechnischen Geräten, Skript von B.H. Brand, Bünde 2013, Download unter: http://www.bhbrand.de
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 29. Juli 2016, Fritz Meiners

