Prof. Blumes Bildungsserver für Chemie
Tipp des Monats März 2017 (Tipp-Nr. 237)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Wenn Schalen schon zu wenig und Orbitale noch zu viel sind.
Das Kugelwolkenmodell.
Wolfram Keil
Bild 1: Verschiedene Materialien zur Darstellung des Kugelwolkenmodells
Gemäß des in vielen Rahmenplänen vorkommenden Struktur-Eigenschafts-Konzepts sollen Schüler befähigt werden, begründete Vermutungen über die Eigenschaften eines Stoffes aus dem Bau seiner Teilchen abzuleiten. Für das Verständnis zwischenmolekularer Kräfte sind Kenntnisse zur Bestimmung des dreidimensionalen Baus der Moleküle eines Stoffes nötig. Damit wären auch Schüler der Sekundarstufe I in der Lage, die Summe der zwischenmolekularen Kräfte zwischen den Teilchen eines Stoffes und damit den Aggregatzustand oder auch die Polarität eines Moleküls und damit die Löslichkeit einzuschätzen. Die Atommodelle im Chemieunterricht
Braucht man denn wirklich noch ein weiteres Atommodell?
Es ist komplex genug, um Informationen zum Molekülbau zu liefern, aber nicht zu komplex, um sich dem Verständnis der Schüler zu entziehen. Der Aufwand zur Einführung des Kugelwolkenmodells ist bei bekanntem Schalenmodell gering. Es muss aber tunlichst vermieden werden, bei der Einführung eines „neuen“ Atommodells das „Alte“ für falsch oder überholt zu erklären. Das führt bei Schülern zu Frustration und der Frage, warum man ihnen denn nicht gleich das „richtige“ Modell beigebracht hätte. Die Modelle stellen alle - auch das Orbitalmodell – eine starke Vereinfachung der Wirklichkeit dar. Denn das ist es ja, was das Wesen eines Modells ausmacht. Die genannten Modelle stehen somit nicht zwingend hierarchisch übereinander, sondern je nach Fragestellung nebeneinander. Es ist also legitim, auch mit Kenntnis des Orbitalmodells, zur Darstellung geeigneter Fragestellungen, wie der Bewegung eines Moleküls im Raum, weiterhin das Kugelteilchenmodell einzusetzen. Zur Veranschaulichung eines Phänomens nutzt man immer das einfachste anwendbare Modell. Da die Aussagen des Schalenmodells auch im Kugelwolkenmodell enthalten sind, wurde von manchen Autoren vorgeschlagen, zugunsten des Kugelwolkenmodells ganz auf die Einführung des Schalenmodells zu verzichten [1]. Aussagen des Kugelwolkenmodells
Zusammengefasst formulierte Kimball zusätzlich zu den Regeln des Schalenmodells sinngemäß die folgenden Ergänzungen: Da sich die negativ geladenen Kugelwolken gegenseitig abstoßen, nehmen sie innerhalb der Schale den größtmöglichen Abstand voneinander ein. Die unterschiedlich große Abstoßung zwischen einfach und doppelt besetzten Kugelwolken wird vernachlässigt. Die erste Kugelwolke entspricht der 1. Schale (K-Schale) und umschließt den Atomkern. Alle weiteren Schalen (bzw. Energieniveaus) können, wenn sie die Außenschale bilden, je nach Anzahl der Außenelektronen 1 bis 4 Kugelwolken mit jeweils ein oder zwei Elektronen enthalten. Enthält die Schale 3 Kugelwolken, liegen sie auf der Äquatorebene des Atomrumpfs. Bei vier Kugelwolken liegen diese auf den Ecken eines gedachten Tetraeders. Ausgehend vom Schalenmodell sind die Neuerungen also nur die Verteilung der Elektronen innerhalb der Schalen auf Kugelwolken in der Schale und die Aufgabe der Vorstellung vom Elektron als punktförmiges Ladungsteilchen. Die Aufteilung der Elektronen in Kugelwolken lässt sich leicht hinnehmen. Wie aber kann man Schülern die neue Ortsunschärfe der Elektronen begreiflich machen? In der Sekundarstufe I kann natürlich nicht mit dem Welle-Teilchen-Dualismus argumentiert werden. Aber man kann Alltagserfahrungen nutzen. Als leicht verständliches Gleichnis können die Rotorblätter eines Hubschraubers dienen. Vor dem Anlassen sieht man zwei schwarze Rotorblätter, die aber ab einer bestimmten Drehzahl nicht mehr einzeln erfasst werden können. Man sieht nur noch eine halbdurchsichtige, graue Scheibe (quasi eine „Kreiswolke“). Die Elektronen bewegen sich mit noch höherer Geschwindigkeit, so dass auch ihre genaue Lage nicht feststellbar ist. Allerdings bewegen sie sich nicht in einer Ebene, sondern in einem kugelförmigen Raum. Dort befinden sie sich gleichzeitig überall und nirgendwo. Das Elektron ist die gesamte Kugelwolke. Diese ist dadurch überall gleichmäßig negativ geladen. Bei der nur modellhaften Annahme, ein Elektron wäre eine sichtbare kleine schwarze Kugel, würden wir bei einer Besetzung mit einem Elektron eine hellgraue und bei Besetzung mit zwei Elektronen eine dunkelgraue Wolke sehen. Damit offenbart sich ein Problem des Kugelwolkenmodells - seine sinnvolle Darstellung. Die Darstellung des Kugelwolkenmodells
Die Verbreitung eines Modells wird natürlich auch durch die Möglichkeit, es schnell und einfach skizzieren zu können, erleichtert. So wird das Schalenmodell häufig noch mit „Planeten“bahnen dargestellt, weil diese sich viel schneller zeichnen lassen als Schalen. Ursprünglich werden beim Kugelwolkenmodell mit einem Elektron einfach (halb-) besetzte Kugelwolken als unausgefüllte (weiße) Kreise und mit zwei Elektronen vollbesetzte Kugelwolken als grau ausgefüllte Kreise dargestellt [1], [4]. Von Schülern wird eine weiße Kugelwolke aber häufig als leere Kugelwolke interpretiert, und ausgefüllte Kugelwolken benötigen Zeit fürs „Ausmalen“. Manche Autoren umgehen die Gefahr der Fehlinterpretation durch die Füllung der Kugelwolken mit unterschiedlichen Farben [5], [6]. Dies erhöht aber auch den Zeichenaufwand und wirft die Frage auf: „Welche Farbe steht für welche Kugelwolke?“ [5] Andere Autoren zeichnen die Elektronen zusätzlich als punktförmige Teilchen oder als Pfeile in farbig oder grau gefüllte Kugelwolken [6], [7] (siehe auch Bilder 1 und 2). Der Zeichenaufwand erhöht sich weiter und die neu eingeführte Ortsunschärfe des Elektrons geht dabei wieder verloren. Bild 2: Vergleich der Verteilung der Elektronen in einem Sauerstoffatom im Schalenmodell und Kugelwolkenmodell ohne Ortsunschärfe
Ab der zweiten Schale existiert innerhalb der Außenschale (innere Schalen werden nicht dargestellt) ein Feinbau aus Kugelwolken, der im Schalenmodell fehlt. Bild 3: Vergleich der Darstellung des Wassermoleküls im Schalenmodell und im Kugelwolkenmodell
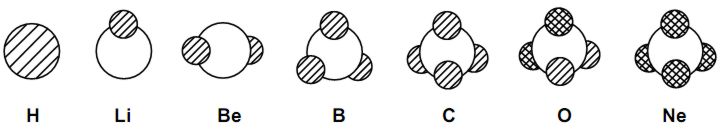
Das Wassermolekül wäre in der Logik des Schalenmodells linear (und somit kein Dipolmolekül) und ein gewinkeltes Dipolmolekül im Kugelwolkenmodell. Ideal für die Nutzung auf Tafel und Papier wäre eine einfarbige, schnelle und un-komplizierte Art der Darstellung. Der folgende, über viele Jahre in der Schulpraxis erprobte Vorschlag soll die oben genannten Probleme lösen. Dieser Vorschlag lässt sich für die Schüler modellhaft wie folgt erklären: Bei sehr hoher Geschwindigkeit der Elektronen in der Kugelwolke wären Richtungsänderungen schwierig und man würde eine Art spiralige Bahnspur wahrnehmen, die von der Seite wie eine Schraffur aussieht. Bei zwei Elektronen in der Wolke wären genau parallele Bahnspuren beider Elektronen unwahrscheinlich. Die Bahnen würden sich in einem Winkel kreuzen. Der Einfachheit halber zeichnet man dann eine im rechten Winkel gekreuzte Schraffur. Dieses Modell im Modell ist zugegeben etwas heikel, weil es der Ortsunschärfe des Elektrons widerspricht, aber die Deutung der Schraffuren wird plausibel. Bild 4: Darstellungen einiger Elemente in der vorgeschlagenen Variante des Kugelwolkenmodells 2D Darstellung
Bild 5: Skizze des Kugelwolkenmodells eines Sauerstoffatoms in 4 Schritten 3D-Modell aus Polystyrolschaumkugeln
In die beiden großen Polystyrolschaumkugeln werden vorsichtig jeweils 8 Löcher gebohrt und darin die Magnete eingeklebt. Die Positionen der Löcher sind: Die Pole und der Äquator der Kugeln sind produktionsbedingt durch kleine Grate gut zu erkennen. In jede der kleinen Kugeln wird nun an einem Pol eine Spanplattenschraube eingeschraubt. Die aufwändigste Arbeit ist das Aufbringen der „Schraffur“ auf die kleinen Kugeln. Mit einem geeigneten Stift zeichnet man auf allen kleinen Kugeln den Äquator nach sowie „nördlich und südlich“ davon je zwei weitere Breitenkreise im gleichen Abstand. Also 5 Kreise pro Kugel. Eine Hälfte der Kugeln wird zusätzlich dazu mit 5 weiteren Breitenkreisen - im rechten Winkel zu den bereits vorhandenen - versehen. Bild 6: Eine einfach und eine doppelt besetzte Kugelwolke der zweiten Schale bzw. Darstellung der Elemente Wasserstoff und Helium (erste Schale) im Kugelwolkenmodell
Durch magnetische Haftung der kleinen Kugeln an der richtigen Stelle der großen Kugeln kann nun jedes Atom und jedes zweiatomige Molekül, das der Oktettregel entspricht, als Kugelwolkenmodell dreidimensional dargestellt werden. Bild 7: Atomrumpf mit eingeklebtem Magneten und magnetisch haftender Kugelwolke
Bild 8: Bor (links) und Sauerstoff (rechts) im Kugelwolkenmodell
Nützlich zur Erklärung der Tetraederwinkel sind zusätzlich ein Tetraeder aus 6 Strohhalmen (24 cm) mit Knetekügelchen an den Ecken und eine tetraedrische Getränkepackung. Bild 9: Gittertetraeder aus Strohhalmen (links) und tetraedrische Saftpackung (rechts)
Tetraedrische Getränkepackungen sind allerdings kaum noch erhältlich, können aber auch einfach selbst gebastelt werden, indem man einen Papierstreifen (z.B. ca. 30 x 15 cm - aus DIN A4-Blatt) an den kurzen Seiten zu einem Ring verklebt. Nun wird die untere Öffnung mit einer Klebenaht oder Heftung verschlossen. Man erhält einer Art Tasche. Die obere Öffnung der Tasche wird nun im rechten Winkel zur unteren Öffnung verschlossen. Schon hat man schnell und unproblematisch einen Papiertetraeder. Am schnellsten geht es mit Klebeband. Bild 10: Bastelanleitung für einen Papiertetraeder
Das die 4 Kugelwolken in die Ecken eines gedachten Tetraeders weisen, kann man zeigen, indem man das Polystyrolschaummodell mit 4 Kugelwolken in den Gittertetraeder aus Strohhalmen stellt. Bild 11: Neonatom im Gittertetraeder
Kugelwolkenmodel und PSE
Bild 12: PSE im Kugelwolkenmodell zum Ausfüllen
Bild 13: PSE im Kugelwolkenmodell Lösung
Die Elektronenpaarbindung (Atombindung) im Kugelwolkenmodell
Dieser Vorgang lässt sich auf dem Overhead-Projektor mit entsprechend bedruckten Folien oder mit Hilfe von GIF-Dateien am Computer sehr gut darstellen. GIF-Dateien eignen sich besonders, weil sich in diesem Format die weißen Bereiche der einfach besetzten Kugelwolken als durchsichtig definieren lassen. Die einfach besetzten Kugelwolken können nun auch grafisch beim Übereinanderschieben ihre einfachen Schraffuren zu einer gemeinsamen, kreuzweisen Schraffur überlagern. So werden sie als doppeltbesetzt erkennbar. Beispiel für eine Einfachbindung:
Bild 14: Zwei Chloratome vor der Bindung
Beide Chloratome (2 Cl) überlappen ihre einfach besetzten Kugelwolken. Bild 15: Chlormolekül als 3D-Modell aus Polystyrolschaumkugeln
Beispiel für eine Doppelbindung:
Bild 16: Sauerstoffmolekül mit Doppelbindung
Bild 17: Sauerstoffmolekül als 3D-Modell aus Polystyrolschaumkugeln
Mit Hilfe des Polystyrolschaummodells lässt sich zusätzlich gut zeigen, dass bei ent-sprechender Anzahl von einfach besetzten Kugelwolken auch Dreifachbindungen möglich, aber Vierfachbindungen unmöglich sind. Der Übergang zur Lewisschreibweise (Valenzstrichformel)
Die Striche und Punkte werden einfach an die vier Seiten des Elementsymbols gezeichnet. Die Dreidimensionalität und Ortsunschärfe der Elektronen geht zu Gunsten der vereinfachten und beschleunigten Schreibweise verloren. Die folgende Abbildung zeigt den Weg vom Kugelwolkenmodell über die Elektronenformel zur Lewisschreibweise am Beispiel des Sauerstoffatoms. Bild 18: Vom Kugelwolkenmodell zur Lewisschreibweise
Fazit
Der Aufwand der Einführung des Kugelwolkenmodells als zusätzliches Atommodell in der Sekundarstufe 1 lohnt sich kurzfristig durch das erleichterte Verständnis der dreidimensionalen Strukturen der Moleküle und der Elektronenpaarbindung, mittelfristig durch die Möglichkeit der Ableitung von Stoffeigenschaften nach dem Struktur-Eigenschafts-Konzept und langfristig als Vorbereitung der Einführung des Orbitalmodells.

(Foto: Keil)
Um die dreidimensionale Struktur von Molekülen zu ermitteln, ist ein geeignetes Atommodell erforderlich. Die Entwicklung der Atomvorstellung verläuft traditionell vom Kugelteilchenmodell (Dalton) im Anfangsunterricht über Kern-Hülle Vorstellungen (Rutherford) zum Schalenmodell (Bohr, Sommerfeld). Für die Mehrheit der Schüler bleibt die Atomvorstellung für den Rest ihres Lebens auf der Stufe des Schalenmodells. Nur ein kleiner Teil der Oberstufenschüler lernt noch das Orbitalmodell (Schrödinger, Heisenberg et al.) kennen.
Das Schalenmodell ist leicht zu versehen, bietet aber keine Möglichkeit der Ableitung dreidimensionaler Strukturen. Das Orbitalmodell jedoch ist Schülern unterhalb des Chemie-Leistungskursnivaus, nur mit übergroßem Aufwand zu vermitteln. Sowohl was die Komplexität als auch die Verwendbarkeit angeht, klafft zwischen dem Schalen- und dem Orbitalmodell eine sehr große Lücke. Diese Lücke kann das relativ einfache und in dreidimensionale Strukturen übersetzbare Kugelwolkenmodell schließen.
Das Kugelwolkenmodell wurde Ende der 50er Jahre von George Kimball als Vereinfachung des Orbitalmodells entwickelt. Die Elektronen werden auch hier nicht mehr als Teilchen, sondern als der Raum ihres wahrscheinlichsten Aufenthalts - hier Wolken statt Orbitale genannt - dargestellt. Im Gegensatz zu den Orbitalen, sind sämtliche Wolken kugelförmig. Die Elektronen aller Unterniveaus (s, p, d, f...) sind somit energiegleich. Dadurch entfällt auch die Hybridisierung. Die maximale Besetzung der Schalen entspricht den Vorgaben des Schalenmodells. Die Außenschale kann (ab der 2. Schale) also maximal 8 Elektronen aufnehmen. Wie bei der Besetzung der sp3-Hybridorbitale werden diese 8 Elektronen innerhalb der Schale auf höchstens 4 Kugelwolken verteilt. Die (zweite) Hundsche Regel gilt auch hier, d. h. die Kugelwolken werden zunächst einzeln und erst ab 5 Außenelektronen doppelt besetzt. Das Pauliprinzip wird außer Acht gelassen.
In der didaktischen Literatur der 70er und 80er Jahre finden sich diverse Artikel zum Kugelwolkenmodell. Es war in dieser Zeit auch in Schulbüchern vertreten [2], [3], verschwand aber Ende der 80er Jahre zunehmend aus den Lehrbüchern [5]. Warum hat es sich in der Schule nicht durchgesetzt? Es könnte an der vorgeschlagenen Art der Darstellung liegen.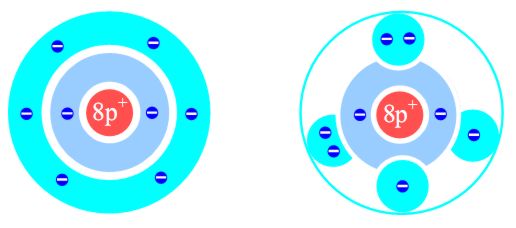
(Grafiken: Keil)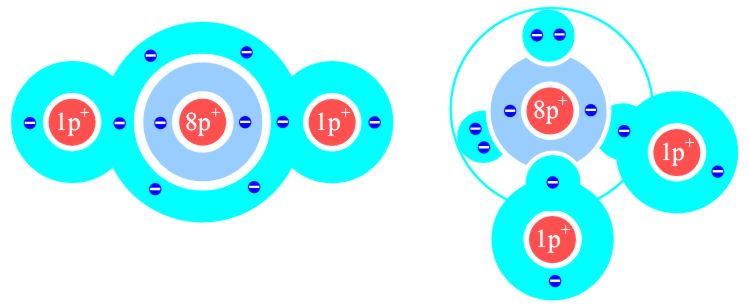
(Grafiken: Keil)
Vorgefertigte Folien für die OHP-Projektion oder GIF-Dateien für Umsetzungen am Computer lassen sich hier zielführend einsetzen, besonders für die Darstellung von Elektronenpaarbindungen zwischen zwei Atomen (siehe unten). Zeichentipps für Tafel, Folie und Papier:
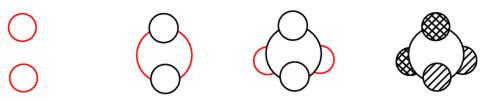
Bei 1-3 Kugelwolken kann auf eine dreidimensionale zeichnerische Umsetzung verzichtet werden. Man setzt hier die Kugelwolken einfach an den Atomrumpf. Ab vier Kugelwolken sollte eine perspektivische Darstellung der Kugelwolken gewählt werden. Dies ist mit vier einfachen Schritten zu erreichen:
Besonders anschaulich - weil wirklich dreidimensional - ist der Einsatz von leicht herzustellenden Modellen aus Polystyrolschaumkugeln. Für einen Satz aus zwei vollständigen Atomen benötigt man:

(Foto: Keil)
(Foto: Keil)
(Fotos: Keil)
(Fotos: Keil)
(Foto: Keil)
(Foto: Keil)
Zur Übung der Übertragung der Informationen aus dem Periodensystem der Elemente in das Kugelwolkenmodell dient die folgende Grafik der Hauptgruppenelemente der ersten drei Perioden in der Darstellung des Kugelwolkenmodells. Obwohl im eigentlichen Kugelwolkenmodell nicht vorgesehen, wurden hier zusätzlich zum besseren Verständnis auch die inneren Elektronen und Atomkerne dargestellt.
(Grafik: Keil)
(Grafik: Keil)
Bei der Einführung der Bindungsarten eignet sich das Kugelwolkenmodell besonders für die Einführung der Elektronenpaarbindung (Atombindung). Bei der Elektronenpaarbindung - übersetzt in das Kugelwolkenmodell - erreichen zwei Atome den Edelgaszustand, indem sie ihre einfach besetzten Kugelwolken überlagern (ineinander schieben), so dass aus zwei einfach besetzten Kugelwolken eine gemeinsame, vollbesetzte Kugelwolke entsteht, das bindende Elektronenpaar. Beide Atome gelangen durch gemeinsame Nutzung von Elektronen in den Edelgaszustand, müssen dafür aber miteinander verbunden bleiben.
Zwei Chloratome nähern sich einander.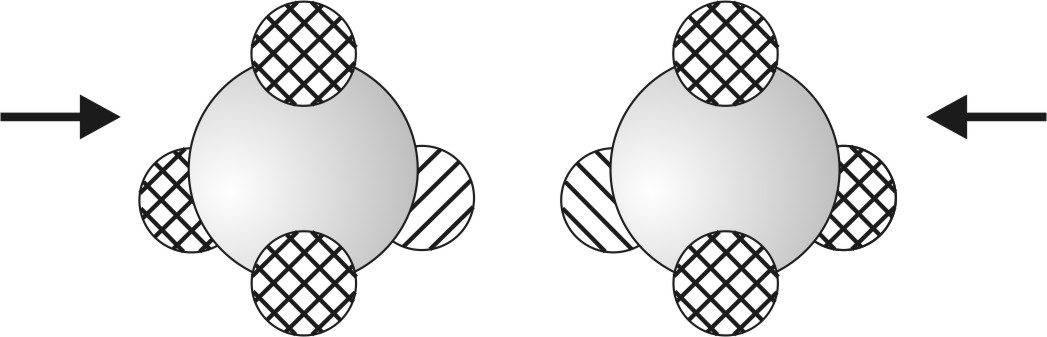
(Grafik: Keil)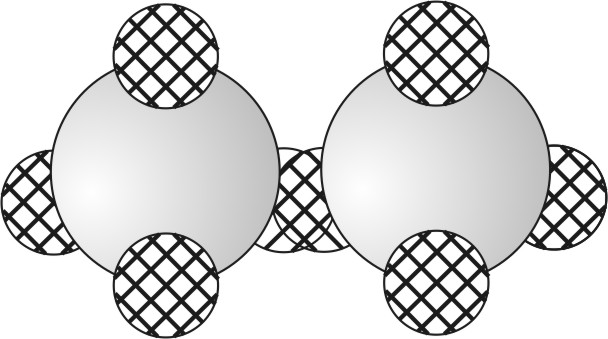
(Grafik: Keil)
Mit dem Schalenmodell können Mehrfachbindungen nicht erklärt werden. Mit dem Kugelwolkenmodell müssen nur die einfach besetzten Kugelwolken zueinander gedreht und zueinander geschoben werden. Zwei Sauerstoffatome (2 O) bilden so ein Sauerstoffmolekül (O2) durch Überlappung von je zwei Kugelwolken pro Atom. Es entstehen zwei bindende Elektronenpaare, also eine Doppelbindung.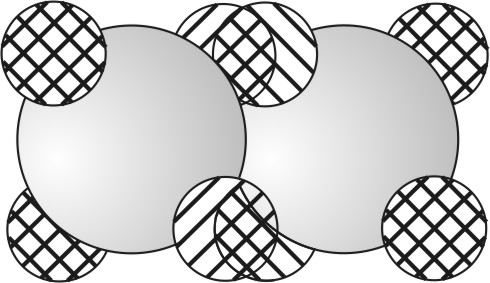
(Grafik: Keil)
(Grafik: Keil)
Die Lewisschreibweise ist eine stark vereinfachte Darstellung des Kugelwolkenmodells und leitet sich von der Elektronenformel ab. Dabei wird die undurchsichtige Kugel des Atomrumpfs durch das Elementsymbol ersetzt. Dadurch entsteht eine zusätzliche Information, denn der Darstellung des Kugelwolkenmodells kann man nur indirekt über die Größe des Atoms entnehmen, um welches konkrete Element es sich handelt, da die inneren Schalen nicht sicht- und zählbar sind. Bei der Elektronenformel werden einfach besetzte Kugelwolken (ein Elektron) als Punkt dargestellt und doppelt besetzte Kugelwolken (zwei Elektronen) als Doppel-punkt. In Kugelwolken gepaarte Elektronen werden bei der Lewisschreibweise als Striche dargestellt. Freie oder bindende Elektronenpaare lassen sich so schneller zeichnen und leichter erkennen.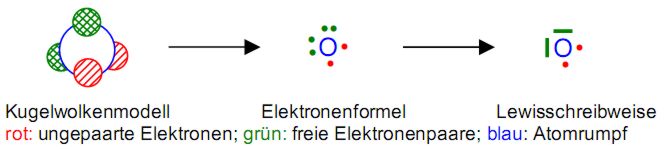
(Grafik: Keil)
Das Kugelwolkenmodell ist auch für Schüler der Sekundarstufe I relativ leicht zu erfassen, und die Einführung bei Kenntnis des Schalenmodells verursacht keinen großen Aufwand. Im Gegensatz zum Schalenmodell können auch Mehrfachbindungen und dreidimensionale Molekülstrukturen einfach erklärt werden. Das Kugelwolkenmodell lässt sich direkt in die Lewisschreibweise übersetzen und umgekehrt. Einige Ideen des Orbitalmodells sind bereits enthalten, so dass der Übergang zum Orbitalmodell vom Kugelwolkenmodell aus viel leichter fällt als vom Schalenmodell. Die Darstellungsprobleme des Kugelwolkenmodells können durch die Schraffur der Kugelwolken gelöst werden. Nebenbei schult das Kugelwolkenmodell dreidimensionales Wahrnehmen und Denken.
Quellen:
[1] Grunenwald M. Atommodelle - Das Kugelwolkenmodell. Berlin: Handout; 1996
[2] Christen HR. Struktur, Stoff, Reaktion. Frankfurt: Diesterweg; 1974
[3] Arndt W, Halberstadt E. Grundzüge der Chemie. 8. Auflage. Frankfurt: Diesterweg; 1975
[4] http://chemie.aabdahl.de/atombau/96kim_kw.php (Zugriff 20.1.17)
[5] http://www.didaktik.chemie.uni-rostock.de/forschung/chemie-fuers-leben-sek-i/4-kugelwolkenmodell/aufbau-des-kwm/ (Zugriff 20.1.17)
[6] http://www.schule-bw.de/unterricht/faecher/chemie/medik/modell/mod4.html (Zugriff 20.1.17)
[7] http://www.u-helmich.de/che/0809/05-molek/mol01.html (Zugriff 20.1.17)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 18. Februar 2017, Fritz Meiners