Prof. Blumes Bildungsserver für Chemie
Tipp des Monats August 2018 (Tipp-Nr. 254)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Streit um eine störende Hecke – mit Essigessenz gelöst?
Uwe Lüttgens
Schon lange schwelt der Streit an der Grundstücksgrenze in einem uckermärkischen Dorf: Einer der beiden benachbarten Gartenbesitzer ärgert sich über die Thuja-Hecke seines Nachbarn, denn diese verschattet seit Jahren zunehmend sein Grundstück. Da sich der benachbarte Heckenbesitzer wenig einsichtig zeigte und die Hecke daher nicht regelmäßig stutzte, verdunkelte sich nicht nur die Rasenfläche mehr und mehr, sondern zunehmend auch die Stimmung zwischen den beiden Dorfbewohnern. Als das Nachbarschaftsverhältnis „grenzheckenbedingt“ seinen Tiefststand erreicht hatte, wusste sich der eine Nachbar nur noch dadurch zu helfen, dass er selbst Hand anlegte – oder vielmehr „pure Chemie“ wirken ließ ... Bild 1: Hecke aus Koniferen
Angetrieben von seinem Zorn goss er reichlich Essigessenz, in der Gießkanne mit Wasser verdünnt, auf das Erdreich – in der Hoffnung darauf, dass die Bäumchen hierdurch absterben. Allerdings blieb die Tat nicht unentdeckt. Die Koniferen-Hecke überlebte den hinterlistigen Säureangriff, das Nachbarschaftsverhältnis starb jedoch endgültig ab. Es kam zu einem juristischen Nachspiel, nachdem die herbeigeeilte Polizei im Mülleimer zahlreiche leere Flaschen der eingesetzten Essigessenz fand. Bild 2: Essigessenz besteht aus 25%iger Essigsäure
Durch Zufall bekam ich das Schreiben des Rechtsanwalts des Geschädigten in die Hände. Der hatte bekanntes Schulbuchwissen über Säuren genutzt, um in den schillerndsten Farben die Wirkungen der Essigsäure auf die Bodenchemie und die Überlebensfähigkeit der Heckenpflanzen auszumalen. Da war von der Gefährlichkeit konzentrierter Säuren die Rede, da diese einen pH-Wert unter 7 hätten und daher gefährlich für Mensch und Boden seien. Überhaupt sind Tonminerale neben den Humusstoffen entscheidend dafür, dass Böden als „Ionentauscher“ fungieren können. Tone sind Schichtsilikate, die durch Verwitterungsprozesse aus Glimmer und Feldspat entstehen können. Die Tonmineralien lagern große Mengen Wasser relativ fest in ihre Schichtgitter ein und sind deshalb auch wenig wasserdurchlässig. Das Schichtgitter der Tonmineralien Betrachten wir den Aufbau etwas genauer: Im Quarzgitter SiO2, in dem Siliciumatome tetraedrisch von Sauerstoffatomen umgeben sind, können an einigen Gitterplätzen diese Siliciumatome ausgetauscht werden. An ihre Stelle treten beispielsweise Aluminiumionen Al3+ - man spricht dann von Alumosilikaten – oder Magnesiumionen Mg2+ - dann haben wir es mit Magnesiumsilikat zu tun. Da diesen Kationen gegenüber den Si4+-Ionen des intakten Quarzgitters Ladungen fehlen, entsteht durch den Austausch ein Überschuss an negativen Ladungen im Schichtsilicat, der z.B. durch Kaliumionen K+, aber auch Wasserstoff-Ionen H+, die sich dort anlagern, ausgeglichen werden kann. Quarz sowie Alumo- bzw. Magnesiumsilikat Bei Humus handelt es sich um abgestorbenes organisches Material, das im Boden stetig ab-, um- und aufgebaut wird. Die wichtigen Huminsäuren sind hochmolekulare Stoffe, die durch den Abbau der pflanzlichen Gerüststoffe Lignin und Cellulose entstehen und angelagerte Protein- und Kohlenhydratstrukturen besitzen. Huminsäuren können an ihren sauren Carboxylgruppen basische Stickstoffverbindungen binden und auch wieder abgeben, wenn metallische Kationen diese Bindungsstellen besetzen. Tonminerale und Humus fungieren als Nährstoffspeicher, indem sie Nährsalze binden, diese den Pflanzen verfügbar machen und ihre Auswaschung verhindern. Wie gut diese Nährstoffe verfügbar sind, hängt u. a. von der Austauschfähigkeit der Humusstoffe und Tonmineralien ab. In einem eher neutralen oder leicht basischen Boden sind die Ton-Humus-Komplexe stabil und deshalb wenig freie Humussäuren vorhanden. Der Materialtransport in untere Bodenschichten ist eher gering. Ist ein Boden hingegen sauer - oder wird dieser, wie in unserem Beispiel, mutwillig angesäuert - werden diese Ton-Humus-Komplexe instabil, Tonpartikel zwischen den Tonschichten umgelagert und Huminsäuren freigesetzt. Die Huminsäuren werden damit mobil und reaktiv. Die Folge ist ein höherer Materialtransport vom A-Horizont in den tiefer liegenden B-Horizont des Bodens. Zu den Huminsäuren haben wir hier weitere Informationen sowie ein kleines Experiment dazu, wie die Huminsäuren im Torf als Kationentauscher fungieren. Ist der Boden leicht sauer, sinkt die Konzentration der in die Schichtstruktur des Tons eingebauten Aluminium- und Magnesiumionen, entsprechend nährstoffärmer werden die Tonböden. Denn: Die Tonmineralien wirken als Ionenaustauscher. Ein Säureeintrag kann die Kaliumionen K+ oder auch die Aluminiumionen Al3+ aus der Schichtstruktur herauslösen, die Bindefähigkeit für diese Kationen ist ebenso herabgesetzt wie die für Huminstoffe, welche komplex an die Schichtsilikate gebunden sind. In der Folge zerfällt das Tonmineral, man sagt, es dispergiert. Sinkt die Korngröße unter ca. 2 µm im Oberboden, dann kann das Sickerwasser die aufgelösten Tonteilchen in den Unterboden transportieren, in dem sie sich erneut ablagern - zum einen, weil dort die Porengröße deutlich kleiner ist als im Oberboden, zum anderen, weil sie dort durch den ansteigenden pH-Wert erneut koagulieren, also wieder zusammenklumpen können. Erkennbar ist dies manchmal an dünnen, schwach glänzenden sogenannten Tonhäutchen, die die Bodenteilchen im Unterboden überziehen. Diese Wanderungsbewegung der Tonminerale führt zur Tonverlagerung, sie wird auch als Lessivierung bezeichnet [2]. Deutlich schwerer in Lösung zu bringen sind die fester in den Carboxylgruppen gebundenen Protonen der Huminsäuren und die Wasserstoff-Ionen, die in den Schichtsilikaten adsorbiert sind – dort liegt das Gleichgewicht für die schwachen Säuren deutlich auf der Seite des Edukts, also auf der Seite der undissoziierten Säure. Wir wollen versuchen, die Wirkung der Essigsäure auf den pH-Wert des Bodens in einem einfachen Modellexperiment zu überprüfen. Dazu gibt es eine DIN-Norm, die DIN-ISO 10390 [3]. In ihr ist genau festgelegt, wie man vorzugehen hat, damit Ergebnisse vergleichbar sind: Zuerst muss eine Suspension des zuvor luftgetrockneten Bodens mit Wasser im Verhältnis 1 zu 5 hergestellt werden – dann kann der aktuelle pH-Wert – man spricht vom pH-H2O - mit einer Glaselektrode bestimmt werden. Interessant ist auch der potenzielle pH-Wert (pH-KCl): Dazu wird die Bodenprobe nicht mit Wasser, sondern mit einer 1 molaren Kaliumchloridlösung behandelt. Als Alternative wird in der Vorschrift auch eine 0,01 molaren Calciumchloridlösung (pH-CaCl2) vorgeschlagen. Versuch: Modellexperiment zum pH-Wert von Bodenproben [4] Material/Chemikalien: 4 Enghals-Erlenmeyerkolben 100 mL, 4 Trichter mit Filterpapier, Messzylinder 10 mL und 50 ml, Löffelspatel, skalierte Einmalpipette 1 mL, kalibriertes pH-Meter, Bodenproben, dest. Wasser, 100 mL Kaliumchloridlösung (c = 1 mol/L), Essigessenz (25 %ige Essigsäure) bzw. verdünnte Essigessenz (0,25 % Essigsäure), Universalindikator Hinweis: Zur Vorbereitung der Bodenuntersuchung sind die verschiedenen Bodenproben zu trocknen. Sinnvoll erscheint die Trocknung im Trockenschrank bei ca. 60°C über einen Zeitraum von ca. 3 h. Durchführung: Vier Bodenproben werden vorbereitet: Die Filter aller vier Proben A, B, C und D werden jeweils mit etwa 10 mL Erde beschickt. Auf die Bodenprobe B und D wird jeweils 1 ml Essigessenz bzw. verdünnte Essigessenz gegeben. Anschließend werden auf die Bodenproben A und B jeweils 50 mL Wasser gegeben; auf die Bodenproben C und D gibt man jeweils 50 mL Kaliumchlorid-Lösung. Anschließend werden die pH-Werte aller zuvor mit 2 Tropfen Indikator versetzten wässrigen Auszüge bestimmt. Hinweis: Man kann zur Herstellung einer Suspension die Bodenproben auch jeweils zuvor in einem Becherglas oder Erlenmeyerkolben mit Wasser bzw. mit der Kaliumchloridlösung versetzen, kurz schütteln und anschließend filtrieren, um anschließend den pH-Wert zu bestimmen. Bild 3: Die vorbereiteten Bodenproben zur Bestimmung des pH-Wertes
Jeweils 10 g Boden werden zur Bestimmung des aktuellen pH-Wertes bei Probe A mit 50 mL Wasser und bei Probe B mit 1 mL 0,25%ige Essigsäure + 50 mL Wasser behandelt. Der potenzielle pH-Wert wird in Probe C mit 50 mL Kaliumchloridlösung und Probe D mit 1 mL 0,25%ige Essigsäure + 50 mL Kaliumchlorid-Lsg. ermittelt. Beobachtung: Der potenzielle pH-Wert C ist niedriger als der aktuelle pH-Wert C. Die wässrigen Auszüge B bzw. D sind aufgrund der zugesetzten Essigsäure deutlich saurer im Vergleich zu den Auszügen A bzw. C. Bild 4: Wässrige Auszüge der Bodenproben – aktueller pH-Wert (A und B) bzw. potenzieller pH-Wert (C und D)

(Foto: Lüttgens)
(Foto: Lüttgens)
Was ist Boden?
Möchtest du Informationen über Böden allgemein, kannst du diese hier finden.
Bevor wir in einem einfachen Modellexperiment den pH-Wert einer Bodenprobe untersuchen, schauen wir etwas genauer auf diese dünne, fruchtbare Erdschicht. Auch wenn häufig von der „märkischen Streusandbüchse“ gesprochen wird, gibt es hier nicht nur Sand. In der Uckermark beispielsweise herrschen zwei Bodentypen vor: Die Braunerden, mit einem hohen Anteil an Tonmineralen, deren braune Farbe auf fein verteiltem Eisenoxid beruht, und die Lessivés. Das ist ein kalk- und silikathaltiger Bodentyp [1]. Hier wurde der Ton aus der oberen Schicht, man spricht vom Oberboden oder A-Horizont, in tiefere Schichten, die als Unterboden oder B-Horizont bezeichnet werden, geschlämmt.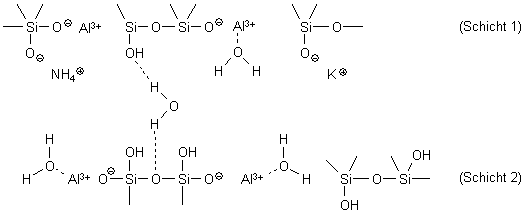
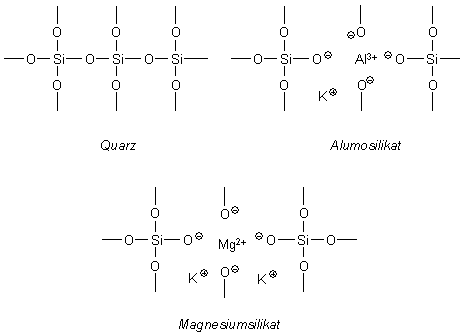
Für Spezialisten: Was ist die Lessivierung von Böden? Wie kommt es zur Tonumlagerung?
Die fruchtbare Parabraunerde, eine Vertreterin der Lessivés, hat durch die vielen Poren im Unterboden eine hohe Wasserspeicherkapazität. Dort sind die für das Pflanzenwachstum notwendigen Nährstoffe verfügbar – der Boden eignet sich daher als Nährstoffspeicher und auch als chemischer Puffer, der Wasserstoffionen aufnehmen und wieder abgeben kann. Der Tonanteil steigt vom Oberboden mit ca. 10 % auf bis zu 25 % im Unterboden an. Ursache ist die Verwitterung der Tonmineralien. Und die ist abhängig vom pH-Wert und von der Temperatur.
Bestimmung des pH-Wertes einer Bodenprobe: Der aktuelle und der potenzielle pH-Wert einer Bodenschicht
Wir wissen: In sauren Verbindungen sind die Wasserstoffionen H+ unterschiedlich fest an die Moleküle gebunden, aus denen ein Boden aufgebaut ist. Diejenigen Protonen, die leicht abgegeben werden, können rasch z. B. durch das Regenwasser ausgewaschen werden. Chemiker sprechen davon, dass das Gleichgewicht zwischen der undissoziierten und der dissoziierten Säure auf der rechten Seite der mit dem Wasser gebildeten Oxonium-Ionen liegt, die das Wasser durch die freigesetzten Protonen rasch ansäuern.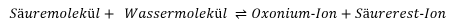
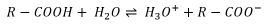
Ein einfaches Modellexperiment: Die Bestimmung des pH-Wertes einer Bodenprobe
Zuvor eine notwendige Überlegung: Bevor wir im Modellexperiment die Wirkung der „Heckenattacke“ im Labormaßstab testen, müssen wir das Verhältnis zwischen der Bodenprobe und dem zugegebenen Essig bzw. der Essigessenz sinnvoll eingrenzen: Gehen wir davon aus, dass der Nachbar je Pflanze 1 l Essigessenz verwendet hat und diese Pflanze ein Erdvolumen von 1 m3 – entsprechend 1000 l – beansprucht, dann ergibt sich daraus ein Verhältnis von 1:1000. Werden in einem vergleichbaren Modellexperiment also 10 mL Bodenprobe eingesetzt, dürfen nur 10 µl Essigessenz hinzupipettiert werden. Da im schulischen Labor kaum geeignete Microliterspritzen vorhanden sein dürften, wird der Einfachheit halber aus der 25%igen Essigsäurelösung (Essigessenz) durch Verdünnung im Verhältnis 1:100 eine 0,25%ige Essigsäurelösung hergestellt, von der entsprechend die hundertfache Menge von 1 ml auf die Bodenprobe gegeben wird, da dieses Volumen leicht zu pipettieren ist.

(Foto: Lüttgens)
(Foto: Lüttgens)
Wir können feststellen, dass das vorherige Ansäuern des Bodens mit jeweils 1 mL 0,25 %iger Essigsäure der pH-Wert ungefähr um 1 abnimmt, die Oxoniumionen-Konzentration also um den Faktor 10 ansteigt. Auch erkennt man, dass der potentielle pH-Wert bei den mit Kaliumchlorid-Lösung eluierten Lösungen deutlich niedriger ausfällt als der aktuelle pH-Wert der mit Wasser eluierten Lösungen.

Bild 4: Vergleichende pH-Wert-Messung von destilliertem Wasser bzw. des mit verdünnter Essigsäure angesäuerten Wassers
(Foto: Lüttgens)
Schauen wir uns die Bodenproben im Vergleich mit destilliertem Wasser bzw. mit angesäuerten Wasser an. Dazu vergleichen wir jeweils die pH-Werte: In beiden Fällen zeigt sich, dass der Boden die pH-Werte anhebt, also eine deutliche Pufferwirkung hat.
Mein Fazit
Ob durch den einmaligen „Säureanschlag“ auf die Koniferen-Hecke, der – wie der einfache Modellversuch zeigt – zu einer merklichen, aber kaum dauerhaften pH-Wert-Absenkung des Bodens geführt haben dürfte, ausreicht, die Bäumchen dauerhaft zu schädigen, oder ob die Pufferwirkung des Bodens ausreicht, dies zu verhindern, vermag ich nicht zu beurteilen. Immerhin reicht die Pufferwirkung des Bodens aus, dass die Oxoniumionen-Konzentration dort „nur“ um eine Größenordnung steigt.
Eines scheint mir jedoch sicher zu sein: Auch wenn immer wieder verärgerte und wohl auch hilf- und ratlose Nachbarn auf solch abstruse Ideen kommen, so empfiehlt es sich doch besser, in einem nachbarschaftlichen Gespräch nach geeigneteren Lösungen Ausschau zu halten – vielleicht stimmt die „Chemie“ an der Hecke bei einem gemeinsamen Glas Bier besser!
Für ihre tatkräftige Unterstützung danke ich Filip Fripan und Adrian Welteke.
Literatur:
[1] Ministerium für Ländliche Entwicklung, Umwelt und Landwirtschaft des Landes Brandenburg: Steckbriefe Brandenburger Böden; https://mlul.brandenburg.de/cms/detail.php/bb1.c.315061.de (zuletzt abgerufen am 26.6.2018)
[2] Spektrum.de - Lexikon der Geographie: Lessivierung; https://www.spektrum.de/lexikon/geographie/lessivierung/4708 (zuletzt abgerufen am 26.6.2018)
[3] International Organization for Standardization: ISO 10390:2005 - Soil quality -- Determination of pH; https://www.iso.org/standard/40879.html oder auf deutsch https://www.beuth.de/de/norm/din-iso-10390/84455065 (zuletzt abgerufen am 26.6.2018)]
[4] Die Idee zu diesem Versuch entstammt: H. Schmidkunz unter Mitarbeit von W. Rentsch, Chemische Freihandversuche, Band 1, Aulis Verlag 2011, S. 253.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 15. Juli 2018, Fritz Meiners